
Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Neues aus der Industrie
{{{sourceTextContent.title}}}
Ist die Darmmikrobiota ein Komplize bei Krebs?
{{{sourceTextContent.subTitle}}}
Ist die Darmmikrobiota ein Komplize bei Krebs?
{{{sourceTextContent.description}}}
Darm-Mikrobiota
Die Darmmikrobiota, die Mikroorganismen, die im menschlichen Darm leben, haben unsere Gesundheit schon seit langem stillschweigend beeinflusst. Sie sind eng mit unseren physiologischen Funktionen verbunden, und manche betrachten sie sogar als ein weiteres "Organ" im menschlichen Körper. Ihre Rolle ist jedoch viel komplexer, als wir uns vorstellen. In den letzten Jahren hat sich die Forschung über die Beziehung zwischen der Darmmikrobiota und Krebs kontinuierlich vertieft und große Aufmerksamkeit auf sich gezogen. Sind diese Mikroorganismen Feinde oder Komplizen des Krebses? Bevor wir uns dieser Frage widmen, sollten wir uns zunächst einige grundlegende Kenntnisse über die Darmmikrobiota verschaffen. Die Darmmikrobiota ist ein komplexes Ökosystem, das sich aus verschiedenen Mikroorganismen zusammensetzt, die unsere Verdauung, unser Immunsystem und andere Systeme durch Interaktionen mit dem Darm beeinflussen. Aufgrund dieser engen Beziehung hat die Darmmikrobiota auch tiefgreifende Auswirkungen auf das Auftreten und die Entwicklung von Krebs.
Wussten Sie jedoch, dass es erhebliche Unterschiede in der Krebsinzidenz und -sterblichkeit zwischen verschiedenen Rassen und Ethnien gibt? In einem in Nature Reviews Cancer veröffentlichten Übersichtsartikel wird erörtert, wie sich Unterschiede in der Darmmikrobiota, die auf soziale, gemeinschaftliche und individuelle Faktoren wie Ernährung, Umwelt, Lebensgewohnheiten und politische Maßnahmen im Rahmen des strukturellen Rassismus zurückzuführen sind, auf die rassischen und ethnischen Ungleichheiten bei Krebs auswirken [1].
Abbildung 1 Expositionen auf mehreren Ebenen, die sich auf die Darmmikrobiota auswirken und in der Folge zu Ungleichheiten bei Krebs beitragen
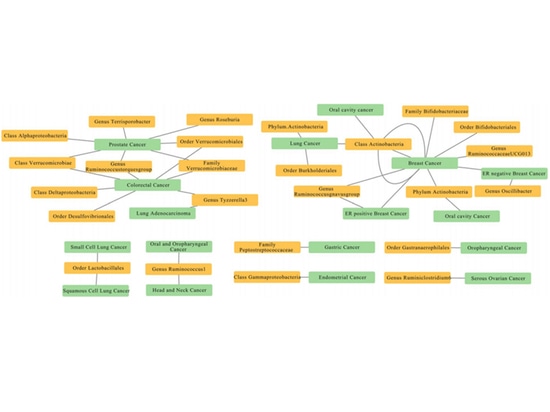
Ob es einen kausalen Zusammenhang zwischen der Darmmikrobiota und Krebs gibt, hat Zhu Hongli vom Xiangya-Krankenhaus anhand öffentlich zugänglicher Datenbanken mit Hilfe der Mendelschen Randomisierung (MR) an zwei Stichproben[2] untersucht und einen gewissen kausalen Zusammenhang zwischen der Darmmikrobiota und acht Krebsarten bestätigt. So gibt es beispielsweise 11 kausale Beziehungen zwischen der genetischen Anfälligkeit der Darmmikrobiota und Krebs, einschließlich der Gattung Bifidobacterium; es gibt 17 starke Korrelationen zwischen der genetischen Anfälligkeit der Darmmikrobiota und Krebs, wie z. B. dass die Familie Bifidobacteriaceae und die Ordnung Bifidobacteriales Risikofaktoren für Brustkrebs sind, während die Gattung UCG013 ein Schutzfaktor gegen Brustkrebs ist. Diese Studie trägt dazu bei, neue Erkenntnisse über die weiteren Mechanismen und die klinische Erforschung von durch die Mikrobiota vermittelten Krebserkrankungen zu gewinnen.
Abbildung 2: Mendelsche Zufallsanalyse des kausalen Zusammenhangs zwischen Darmflora und Krebs
Die Häufigkeit von Darmkrebs (CRC) nimmt zu und macht ihn zur zweithäufigsten krebsbedingten Todesursache weltweit, was den dringenden Bedarf an verbesserten Präventions- und Behandlungsstrategien unterstreicht. Die Darmmikrobiota, die aus Billionen von Mikroorganismen besteht, wird eng mit dem Auftreten und dem Fortschreiten von Darmkrebs in Verbindung gebracht. Ein kürzlich in Nature Reviews Microbiology [3] veröffentlichter Übersichtsartikel fasst die Forschungsergebnisse über die allgemeine Störung der Darmmikrobiota und die Assoziation bestimmter Mikroorganismen mit Darmkrebs bei Patienten zusammen. Es wurden die potenziellen Mechanismen erläutert, durch die Mikroben das Auftreten von Darmkrebs fördern, sowie die mögliche Rolle komplexer mikrobieller Gemeinschaften bei der Pathogenese von Darmkrebs. Darüber hinaus wurden die klinischen Aussichten von auf die Mikrobiota ausgerichteten Strategien zur Prävention und Behandlung von Darmkrebs erörtert.
Abbildung 3 Mikrobielle Mechanismen des kolorektalen Karzinoms
Bei der Erforschung des kolorektalen Karzinoms ist die Beziehung zwischen der Darmmikrobiota und Krebs besonders faszinierend. Es wurde festgestellt, dass bestimmte Darmbakterien mit einem erhöhten Darmkrebsrisiko in Verbindung gebracht werden, während andere möglicherweise eine schützende Wirkung haben. Diese Erkenntnisse eröffnen neue Wege für die künftige Prävention und Früherkennung von Krebs. Bei der Verursachung von Darmkrebs durch die Darmmikrobiota spielen die von der Darmmikrobiota produzierten Metaboliten eine entscheidende Rolle. Sie können die Mikroumgebung des Tumors umgestalten, wichtige Signalwege in Krebszellen und verschiedenen Immunzellen regulieren und so das Auftreten und die Entwicklung von Krebs sowie die Wirksamkeit der Krebsbehandlung beeinflussen. Das Team um Meng Xuli vom Zhejiang Provincial People's Hospital hat kürzlich eine umfassende Übersichtsarbeit in der Zeitschrift Advanced Science veröffentlicht, in der die Mechanismen beschrieben werden, durch die Metaboliten der Darmmikrobiota das Fortschreiten von Krebs beeinflussen, sowie ihre Rolle bei der Strahlen-, Chemo- und Immuntherapie[4].
Abbildung 4: Mikrobielle Metaboliten sind an der Signalregulation von Tumorzellen und der Tumorprogression beteiligt
Mikrobielle Metaboliten sind ein entscheidendes Bindeglied zwischen Darmbakterien und Krebs. Sie regulieren das Fortschreiten von Krebs, indem sie die Mikroumgebung des Tumors umgestalten und die Funktion der Immunzellen und den Zytokinspiegel beeinflussen. Diese Metaboliten modulieren Signalwege wie MAPK, PI3K/Akt und Wnt und beeinflussen so die Vermehrung von Tumorzellen, die Apoptose und die Metastasierung sowie die Abschwächung von Nebenwirkungen und die Wirksamkeit von Strahlen-/Chemotherapie. Neben den traditionellen Strategien, die Antibiotika zur Störung der Mikrobiota einsetzen, wurden neue Ansätze entwickelt, die auf mikrobiellen Metaboliten basieren, einschließlich Ernährung, Medikamentenentwicklung, Transplantation der fäkalen Mikrobiota und Probiotika. Bei der Behandlung ist es von entscheidender Bedeutung, den Zustand des Patienten umfassend zu berücksichtigen, um Konflikte zwischen Metaboliten, Mikrobiota und Krebsmedikamenten zu vermeiden, die die Behandlung unwirksam machen oder die Nebenwirkungen verschlimmern könnten. Dies unterstreicht das Potenzial für eine bessere Anwendung von mikrobiellen Metaboliten in der Krebsbehandlung und die Entwicklung neuer therapeutischer Strategien auf der Grundlage dieser Metaboliten, die Aufmerksamkeit verdienen.
Auch bei der Behandlung spielt das Mikrobiom eine entscheidende Rolle in der Krebstherapie. So wird beispielsweise die Wirksamkeit von Immun-Checkpoint-Inhibitoren sowohl von der Darm- als auch von der Tumormikrobiota beeinflusst. Darüber hinaus spielen die von Darmbakterien produzierten Metaboliten eine wichtige Rolle bei der Tumorprogression und der Krebsbehandlung. Diese Erkenntnisse liefern neue Erkenntnisse und potenzielle therapeutische Ziele für die künftige Krebsbehandlung.
In den letzten zehn Jahren hat die Krebsbehandlung eine Revolution erlebt, die von traditionellen Therapien zu Immun-Checkpoint-Inhibitoren (ICI) führte. Diese Immuntherapien können das Wirtsimmunsystem zur Bekämpfung von Tumoren anregen und haben bisher nie dagewesene langfristige Remissionserfolge erzielt. Ein Übersichtsartikel in Trends in Molecular Medicine untersucht die unerwartete Rolle von Bakterien bei der Neugestaltung der Immunreaktionen von Tumoren. Es wird erwartet, dass die Erforschung symbiotischer Gemeinschaften und des Tumormikrobioms Aufschluss darüber geben wird, welche Patienten von einer Immuntherapie profitieren können, und dazu beitragen wird, den Anwendungsbereich der ICI-Behandlung zu erweitern und die Behandlungsergebnisse zu verbessern[5].
Forschungen haben ergeben, dass Krebspatienten mit einer hohen Diversität der Darmmikrobiota besser auf eine Therapie mit Immun-Checkpoint-Inhibitoren (ICI) ansprechen. Die Darm- und Tumormikrobiota kann die Expressionswerte von Immun-Checkpoint-Molekülen auf Immunzellen direkt herunterregulieren und Anti-Tumor-Immunzellen mobilisieren, indem sie Metaboliten wie Indol, Adenosin und kurzkettige Fettsäuren produziert; die Darmmikrobiota kann ICI-bedingte Nebenwirkungen wie Kolitis reduzieren; eine Dysbiose kann zu einer übermäßigen Produktion von Entzündungsfaktoren führen, was die Nebenwirkungen der ICI-Therapie verschlimmert; klinisch können diätetische Interventionen, Präbiotika, Probiotika, fäkale Mikrobiota-Transplantation und Antibiotika eingesetzt werden, um die Zusammensetzung der Darmmikrobiota und die Wirksamkeit der ICI zu verbessern.
Abbildung 5 Die treibende Rolle der intratumoralen Bakterien bei der Tumorprogression
Die Beziehung zwischen Krebs und der Darmmikrobiota ist ein komplexes und multidimensionales Thema. Es gibt immer mehr Hinweise darauf, dass das Mikrobiom eine entscheidende Rolle bei der Entstehung und Behandlung von Krebs spielt. Die Frage, ob die Mikrobiota bei Krebs als Feind oder als Komplize agiert, ist jedoch nach wie vor ein spezielles Thema, das eine detaillierte Analyse erfordert.
Insgesamt spielt die Darmmikrobiota eine unbestreitbare Rolle bei der Entstehung und Behandlung von Krebs. Auch wenn ihre spezifischen Mechanismen und potenziellen therapeutischen Strategien noch weiter erforscht werden müssen, ebnen diese Forschungsergebnisse zweifellos den Weg für neue Richtungen in der künftigen Krebsforschung. In künftigen Studien ist ein tieferes Verständnis der Interaktion zwischen der Darmmikrobiota und Krebs notwendig, um wirksamere personalisierte Behandlungspläne für Patienten bereitzustellen.
Quellenangaben:
[1] Byrd D, Wolf P. The microbiome as a determinant of racial and ethnic cancer disparities. Nat Rev Cancer. 2023 Oct 23.
[2] Long Y, Tang L, Zhou Y, Zhao S, Zhu H. Kausale Beziehung zwischen Darmmikrobiota und Krebserkrankungen: eine Mendelsche Randomisierungsstudie mit zwei Stichproben. BMC Med. 2023 Feb 21;21(1):66.
[3] White MT, Sears CL. Die mikrobielle Landschaft des kolorektalen Krebses. Nat Rev Microbiol. 2023 Oct 4.
[4] Yang Q, Wang B, Zheng Q, Li H, Meng X, Zhou F, Zhang L. A Review of Gut Microbiota-Derived Metabolites in Tumor Progression and Cancer Therapy. Adv Sci (Weinh). 2023 May;10(15):e2207366.
[5] Guillot N, Roméo B, Manesh SS, Milano G, Brest P, Zitvogel L, Hofman P, Mograbi B. Manipulating the gut and tumor microbiota for immune checkpoint inhibitor therapy: from dream to reality. Trends Mol Med. 2023 Nov;29(11):897-911.
Hinweis: Dieser Text ist nur zur Weitergabe bestimmt. Sollte es Probleme mit dem Urheberrecht geben, setzen Sie sich bitte so schnell wie möglich mit uns in Verbindung, und wir werden dies umgehend korrigieren. Wir danken Ihnen!

{{medias[59629].description}}
{{medias[59630].description}}

{{medias[59631].description}}

{{medias[59634].description}}

{{medias[59635].description}}




