Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Produkttrends
{{{sourceTextContent.title}}}
Der Zusammenhang zwischen Schilddrüsenkrebs und dem BRAF-Gen
{{{sourceTextContent.subTitle}}}
Der Zusammenhang zwischen Schilddrüsenkrebs und dem BRAF-Gen
{{{sourceTextContent.description}}}
In den letzten Jahren hat die Häufigkeit von Schilddrüsenkrebs in vielen Ländern und Regionen der Welt weiter rapide zugenommen. Jedes Jahr gibt es weltweit fast 600.000 neue Fälle, von denen mehr als ein Drittel auf chinesische Patienten entfällt (Abbildung 1). Das Verhältnis von weiblichen zu männlichen Patienten beträgt etwa 3:1 [1].
Abbildung 1: Die zehn häufigsten Krebsarten mit den meisten Neuerkrankungen in China im Jahr 2020
Schilddrüsenkrebs ist der häufigste bösartige endokrine Tumor und geht von follikulären oder parafollikulären Epithelzellen der Schilddrüse aus (Abbildung 2). Je nach Ursprung und Differenzierung des Tumors kann Schilddrüsenkrebs in differenzierten Schilddrüsenkrebs (DTC), medullären Schilddrüsenkrebs (MTC), schlecht differenzierten Schilddrüsenkrebs (PDTC) und anaplastischen Schilddrüsenkrebs (ATC) unterteilt werden. DTC wird weiter unterteilt in papillären Schilddrüsenkrebs, Schilddrüsenkrebs (PTC) und follikulären Schilddrüsenkrebs (FTC) [2]. Unter allen Gewebearten ist PTC mit etwa 90 % aller Schilddrüsenkarzinome am häufigsten. Studien haben gezeigt, dass das am häufigsten mutierte Gen bei PTC BRAF ist, mit einer Mutationsrate von bis zu 80 %; bei ATC sind Mutationen weniger häufig, und bei gutartigen Knoten, FTC, MTC und PDTC sind Mutationen selten [3]. Seit der ersten Entdeckung von BRAF-Genmutationen bei menschlichen Krebserkrankungen wurden mehr als 40 Mutationsstellen identifiziert, von denen die T1799A-Stelle die häufigste BRAF-Mutation ist und für mehr als 90 % aller BRAF-Genmutationen verantwortlich ist. Die T1799A-Stelle befindet sich auf Exon 15 des BRAF-Gens. Die Mutation an dieser Stelle führt dazu, dass das Valin (V) an Position 600 im Proteinprodukt durch Glutaminsäure (E) ersetzt wird (V600E genannt), wodurch die BRAF-Kinase aktiviert wird, was zur Krebsentstehung führt [4]. Die BRAF-V600E-Mutation steht in engem Zusammenhang mit PTC und ist ein sehr wichtiger Tumormarker für PTC. Das Risiko bösartiger Schilddrüsenknoten mit BRAF-Mutation liegt bei 99,8 % [3]. Gleichzeitig stehen BRAF-Mutationen in engem Zusammenhang mit der klinischen Progression, dem Wiederauftreten und der Jodresistenz von PTC.
Abbildung 2 Schilddrüse
BRAF-Mutation und klinisches Fortschreiten des PTC
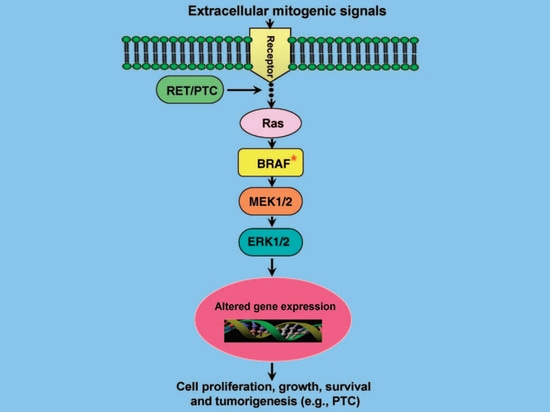
Das BRAF-Gen kodiert für eine Serin/Threonin-Proteinkinase und ist ein wichtiger Bestandteil des MAPK-Signaltransduktionswegs (RAS-RAF-MEK-ERK/MAPK-Kinaseweg). Dieser Signalweg spielt eine wichtige Rolle bei der Zellproliferation, Differenzierung, Apoptose und anderen Zellfunktionen. Wenn er abnormal aktiviert wird, entstehen Tumore. In normalen Zellen wird die physiologische Aktivierung dieses Signalwegs durch eine große Anzahl von Wachstumsfaktoren, Hormonen und Zytokinen über ihre Rezeptoren an der Zellmembran ausgelöst und aktiviert dann die RAF-Kinase über GTP-RAS, wodurch die nachgeschaltete MEK aktiviert wird, die wiederum die nachgeschaltete ERK aktiviert; die aktivierte ERK phosphoryliert regulatorische Proteinmoleküle im Zellkern und verändert schließlich die Genexpression, wodurch die biologische Aktivität der Zelle verändert wird (Abbildung 3) [5]. Wenn das BRAF-Gen mutiert ist, bleibt es daher weiterhin aktiv und aktiviert kontinuierlich den MAPK-Signalweg in Tumorzellen, wodurch das Wachstum und die Entwicklung der Zellen außer Kontrolle geraten und schließlich ein Tumor entsteht [5]. Darüber hinaus haben Studien gezeigt, dass BRAF-Mutationen eine abnorme Methylierung von PTC-verwandten Tumorsuppressorgenen (TIMP3, DAPK, SLC5A8, RARβ2 usw.) induzieren, was die Tumorprogression beschleunigt [6]. Das Tumorsuppressorgen TIMP3 beispielsweise kann das Tumorwachstum, die Angiogenese, die Invasion und die Metastasierung hemmen und die Bindung des vaskulären endothelialen Wachstumsfaktors (VEGF) an den VEGF-Rezeptor blockieren; BRAF-Mutationen bewirken jedoch eine Methylierung des TIMP3-Gens, wodurch das Gen zum Schweigen gebracht wird. Dies führt zu einem Verlust der Genfunktion und fördert das Fortschreiten und die Invasivität von PTC [7].
Abbildung 3 MAPK-Signalweg
BRAF-Mutation und PTC-Rezidiv
Die meisten Studien haben gezeigt, dass BRAF-Mutationen das Risiko eines PTC-Rezidivs erhöhen, und zwar unabhängig von der Höhe des Risikos in Verbindung mit klinisch-pathologischen, geografischen und ethnischen Faktoren. Xing et al. führten eine multizentrische Studie an 219 PTC-Patienten durch und analysierten retrospektiv den Zusammenhang zwischen BRAF-Mutationen und Tumorrezidiven bei primären PTC. Die Ergebnisse bestätigten, dass BRAF-Mutationen eng mit dem Wiederauftreten von PTC zusammenhängen [8]. Eine Studie von Kim et al. zeigte ebenfalls, dass bei 203 Patienten mit primärem PTC eine BRAF-Mutation in engem Zusammenhang mit einem Tumorrezidiv stand [9].
Abbildung 4 Vergleich der Rezidivfreiheitswahrscheinlichkeit bei PTC-Patienten mit BRAF-Genmutationen und solchen ohne Mutationen
BRAF-Mutation und Jodresistenz bei PTC
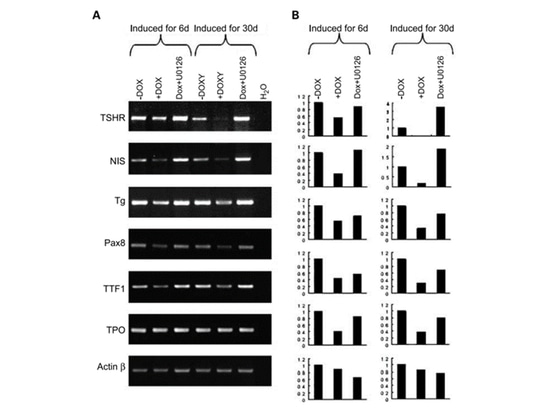
Nach der Thyreoidektomie ist die radioaktive Jodablation die primäre Behandlung des PTC. Bei dieser Therapie mit radioaktivem Jod wird der Natrium-Jodid-Kotransporter (NIS) der Schilddrüsenzellen genutzt, um Jodid aufzunehmen, zu konzentrieren und zu organisieren. Dieser Prozess erfordert die Beteiligung von Thyreotropinrezeptor (TSHR), Thyreoglobulin (Tg), Schilddrüsenperoxidase (TPO) und den Transkriptionsfaktoren TTF-1 und Pax-8 [4]. Die Expression dieser Gene, die mit dem Jodstoffwechsel zusammenhängen, ist jedoch bei primärem oder rezidivierendem PTC häufig geschädigt oder verloren, und Studien haben ergeben, dass dies mit BRAF-Mutationen zusammenhängt [10]. In einer Studie [10] wurde die Expression von BRAF V600E induziert und die Aktivität des MAPK-Signalwegs verändert, woraufhin die Expression von Genen des Jodstoffwechsels der Schilddrüse nachgewiesen wurde. Durch Induktion der Expression von BRAF V600E mit DOX (Doxycyclin) für 6 Tage wurde die Expression der Gene TSHR, NIS, Tg und PAX8, die mit dem Jodstoffwechsel zusammenhängen, herunterreguliert; durch Zugabe von U0126 (MEK-Inhibitor) konnte die Expression der herunterregulierten Gene wiederhergestellt werden. Nach einer Langzeitinduktion von BRAF V600E (30 Tage) konnten diese zum Schweigen gebrachten Gene des Jodstoffwechsels der Schilddrüse durch die Behandlung mit U0126 wiederhergestellt werden. Die Forschungsergebnisse zeigen, dass eine Therapie, die auf den RAF-MEK-MAP-Signalweg abzielt, ein guter Weg ist, um die Jodstoffwechselfähigkeit von PTC mit BRAF-Mutationen wiederherzustellen.
Abbildung 5 Studie über die Expression von Jodstoffwechselgenen
Zusammenfassend lässt sich sagen, dass BRAF-Genmutationen eng mit papillärem Schilddrüsenkrebs (PTC) verbunden sind, als prädiktiver Marker für die PTC-Prognose verwendet werden können und auch eng mit der Patientenprognose zusammenhängen. Ein BRAF-Gentest hat bei PTC einen offensichtlichen klinischen Wert. Neben seinem prognostischen Wert kann er auch das Malignitätsrisiko von Schilddrüsenknoten bewerten, bei der Auswahl von Operationsplänen helfen und eine gezielte Therapie anleiten. Es können jedoch auch RET/PTC-Rearrangements, Ras-Mutationen usw. im MAPK-Signalweg vorhanden sein, die sich mit BRAF-Genmutationen gegenseitig ausschließen [11].
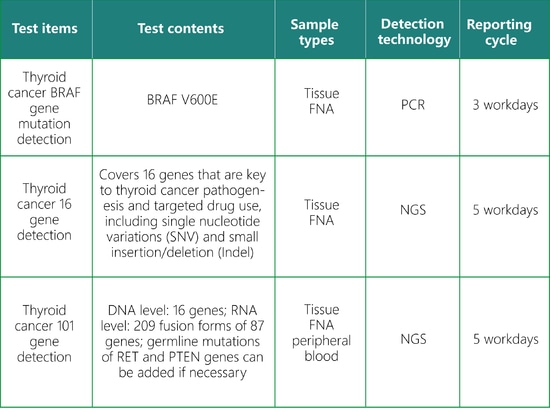
SpaceGen Gentests für Schilddrüsenkrebs
Der SpaceGen-Genmutationsnachweis für Schilddrüsenkrebs ermöglicht eine wissenschaftliche und genaue Einschätzung des individuellen Schilddrüsenkrebsrisikos und die Ausarbeitung eines individuellen Behandlungsplans.
Referenzen
[1] IARC 2020, neueste Daten zur globalen Krebsbelastung.
[2] Leitlinien zur Diagnose und Behandlung von Schilddrüsenkrebs (Ausgabe 2022)
[3] Guangdong Expert Consensus on Gene Testing and Clinical Application of Thyroid Cancer (Ausgabe 2020)
[4] Critical Reviews in Oncology/Hematology, 2014, 90(3).
[5] Endocrine Reviews 28(7):742-762.
[6] J Clin Endocrinol Metab 90:3028 -3035.
[7] Biochem Cell Biol 74:853- 862.
[8] J Clin Endocrinol Metab 90:6373- 6379.
[9] Clin Endocrinol (Oxf) 65:364 -368.
[10] Clin Cancer Res, 2007, 13(4): 1341-1349.
[11] CSCO-Leitlinien für die Diagnose und Behandlung von differenziertem Schilddrüsenkrebs (Ausgabe 2021)
Erklärung: Dieser Artikel dient nur zur Weitergabe und stellt nicht die Position der Plattform dar. Sollte es Probleme mit dem Urheberrecht oder andere Probleme geben, kontaktieren Sie uns bitte so schnell wie möglich und wir werden den Fehler so schnell wie möglich korrigieren. Wir danken Ihnen!