#Produkttrends
Die Biomarker von Subtypen bei Endometriumkarzinom
Die molekulare Subtypisierung von Endometriumkarzinomen (EC) ist in den letzten Jahren zu einem heißen Thema auf dem Gebiet der gynäkologischen Onkologie geworden.
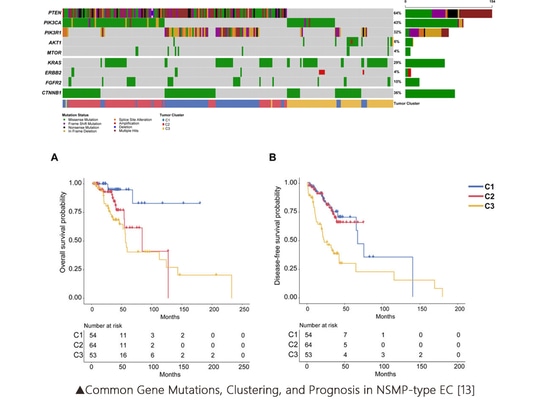
Die Klassifikation der EC hat sich von einer einfachen histologischen Klassifikation zu einer molekulargenetischen Klassifikation entwickelt. Durch Hochdurchsatzsequenzierung (NGS) und andere Nachweismethoden wurde EC in vier molekulare Subtypen mit erheblichen Unterschieden eingeteilt. Zu den wesentlichen Markern für diese Klassifizierung gehören POLE, MMR/MSI und TP53/p53. In der Cancer Genome Atlas (TCGA)-Studie gibt es zusätzlich zu den oben genannten Subtyp-Markern auch viele häufig mutierte Gene, wie PTEN, KRAS, PIK3CA, CTNNB1 usw. Mit fortschreitender Forschung ändern sich die Rollen dieser ergänzenden Subtyp-Marker wird laufend enthüllt.
Merkmale des molekularen Subtyps TCGA [1-2]
Zusätzlich zur ergänzenden Subtypisierung weisen 67 % bis 91 % der EC-Patienten mindestens eine genetische Mutation auf, die möglicherweise als Ziel für von der FDA zugelassene Medikamente oder Medikamente im Stadium klinischer Studien dienen könnte. Derzeit gibt es mehrere klinische Studien zu Krebserkrankungen, die die Wirksamkeit gezielter Therapien auf Gene wie PI3K/AKT/mTOR, KRAS, AKT1, FGFR2, FBXW7 und PTEN[3] untersuchen.
01 CTNNB1
CTNNB1 ist wahrscheinlich eines der am ausführlichsten untersuchten Gene für ergänzende Subtypen. Dieses Gen kodiert für Beta-Catenin, das eine Rolle bei der Regulierung der Zelladhäsion und der Zellsignalisierung spielt[4]. Die Mutationshäufigkeit des CTNNB1-Gens im CN-L-Subtyp beträgt 52 %[1]. Einige frühe Studien ergaben, dass bei EC-Patienten im G1/2- und I/II-Stadium trotz geringer Raten an lymphovaskulärer Rauminvasion (LVSI) und Muskelinfiltration pathogene Mutationen auf Exon 3 des CTNNB1-Gens mit einem schlechteren rezidivfreien Überleben verbunden waren ( RFS) mit einer Hazard Ratio (HR) von 5,97. Tumoren mit CTNNB1-Mutationen zeigten auch eine deutlich geringere Wahrscheinlichkeit für Mutationen in KRAS, TP53 und FGFR2[5].
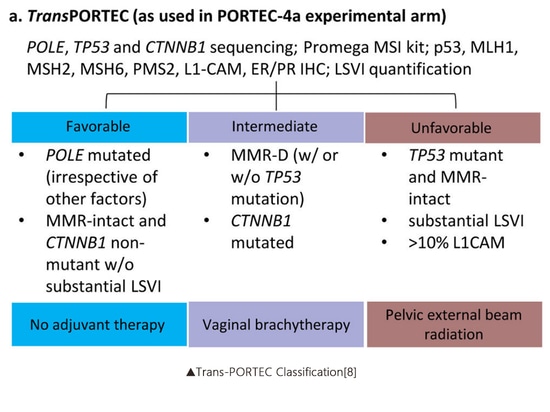
Im Jahr 2016 kombinierten Stelloo et al., aufbauend auf der ProMisE-Klassifikation, CTNNB1-Exon-3-Mutationen, hohe L1CAM-Expression (>10 %) und LVSI, um die Trans-PORTEC-Klassifizierung (günstig, mittel und ungünstig) weiter vorzuschlagen. Ziel dieser Klassifizierung war es, eine genauere Risikostratifizierung für den größten und heterogensten Subtyp des Endometriumkarzinoms, den sogenannten Non-Specific Molecular Profile (NSMP)-Typ, zu ermöglichen. Es wurde festgestellt, dass die Prognose für den CTNNB1-Exon-3-Mutationssubtyp schlechter war als für den Wildtyp-Subtyp[6]. Die PORTEC-4a-Studie (NCT03469674) ist die weltweit erste klinische Studie, die adjuvante Behandlungsstrategien auf der Grundlage molekularer Subtypisierung bestimmt. Ziel der Studie ist es, die Wirksamkeit einer adjuvanten Behandlung auf der Grundlage einer umfassenden Risikoanalyse aus der molekularen Subtypisierung mit der standardmäßigen vaginalen Brachytherapie bei Endometriumkarzinom zu vergleichen. Die verwendete Schichtungsmethode ist die oben erwähnte Trans-PORTEC-Klassifikation[7].
▲Trans-PORTEC-Klassifizierung[8]
Zusätzlich zur Hilfssubtypisierung können Mutationen im CTNNB1-Gen auch Hinweise auf die Wirksamkeit der Behandlung geben. Eine Phase-II-Studie (NCT01068249) zeigte, dass Patienten mit EC, die CTNNB1-Mutationen aufweisen, von der Kombination von Everolimus und Letrozol profitieren können[9]. Dieser Behandlungsansatz ist gemäß den Richtlinien des National Comprehensive Cancer Network (NCCN) auch eine bevorzugte Option für die Hormontherapie bei rezidivierendem oder metastasiertem EC[10].
In Bezug auf die Nachweismethoden für CTNNB1-Mutationen könnte die Immunhistochemie (IHC) für die nukleare Beta-Catenin-Expression als Alternative zum Nachweis von CTNNB1-Exon-3-Mutationen dienen, NGS-Tests bleiben jedoch der Goldstandard[4].
02 PTEN
PTEN ist ein Tumorsuppressorgen. Das PTEN-Protein besitzt sowohl Proteinphosphatase- als auch Lipidphosphatase-Aktivitäten und ist an der Regulierung des Zellzyklus, der Proliferation und der DNA-Reparatur beteiligt, indem es den PI3K/AKT-Signalweg hemmt. Darüber hinaus beeinträchtigt der Verlust von PTEN die Funktion des CHK1-Proteins, was zur Anhäufung von DNA-Doppelstrangbrüchen und genomischer Instabilität führt. Es reguliert auch die Expression von RAD51, einem Schlüsselprotein bei der Reparatur der homologen Rekombination (HR)[11].
▲Hauptfunktionen von PTEN [12]
PTEN-Genmutationen sind die häufigsten somatischen Mutationen beim endometrioiden Endometriumkarzinom (EEC) und stellen frühe, aber noch nicht vollständig nachgewiesene Ereignisse in der Tumorentstehung dar[8]. Hohe Mutationshäufigkeiten werden beim hypermutierten POLE-Subtyp, beim MSI-H-Subtyp mit hoher Mutation und beim CN-L-Subtyp mit Raten von 94 %, 89 % bzw. 77 % beobachtet. Beim CN-H-Subtyp beträgt die Mutationshäufigkeit von PTEN nur 11 % bis 15 %, und PTEN-Genmutationen sind bei serösen Karzinomen selten (2 %)[1]. In EEC treten PTEN-Mutationen häufig gleichzeitig mit PIK3CA- und PIK3R1-Mutationen auf, und der Verlust von PTEN zeigt auch synergistische Effekte mit CTNNB1-Mutationen oder MLH1-Inaktivierung[7]. In den meisten EEC-Fällen schließen sich PTEN-Mutationen und TP53-Mutationen oft gegenseitig aus. Allerdings weisen etwa 50 % der hochgradigen EEC-Fälle mit TP53-Mutationen gleichzeitig PTEN-Mutationen auf, wobei sowohl TP53- als auch PTEN-Mutationen nicht stumm sind[1].