#Produkttrends
Eines der heißen Ziele in der Pan-Krebs-Therapie – FGFR
Die FGFR-Familie (Fibroblast Growth Factor Receptor) besteht hauptsächlich aus vier Subtypen: FGFR1, FGFR2, FGFR3 und FGFR4.
Hintergrund:
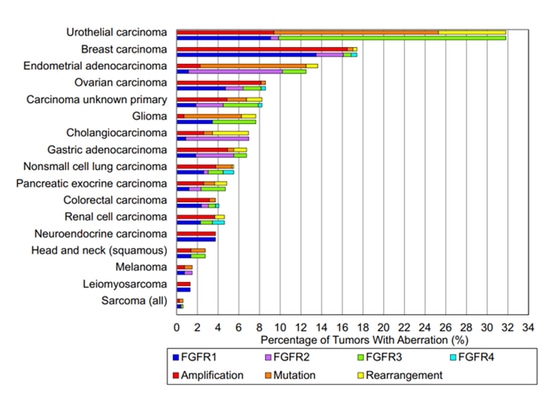
Die FGFR-Familie (Fibroblast Growth Factor Receptor) besteht hauptsächlich aus vier Subtypen: FGFR1, FGFR2, FGFR3 und FGFR4. Jeder Subtyp besitzt ein Strukturmuster, das aus einem extr. besteht. Die FGFR-Familie (Fibroblast Growth Factor Receptor) besteht hauptsächlich aus vier Subtypen: FGFR1, FGFR2, FGFR3 und FGFR4. Jeder Subtyp besitzt eine konazelluläre Strukturmusterdomäne für die Ligandenbindung, eine Transmembrandomäne und eine intrazelluläre Domäne für die Rezeptorphosphorylierung. Diese Rezeptoren sind Teil des Tyrosinkinase-Signalwegs, der für die Zellproliferation und -differenzierung verantwortlich ist. Molekulare Veränderungen des FGFR können zu fehlerhaften FGF/FGFR-Signalen führen und so die Zellproliferation, Angiogenese, Invasion, Metastasierung und Anti-Apoptose fördern, die mit einer Vielzahl menschlicher bösartiger Erkrankungen verbunden sind. Die Fusion und Dysregulation von FGFR stehen in engem Zusammenhang mit dem Auftreten und der Entwicklung verschiedener Krebsarten. Derzeit wurden Variationen des FGFR-Gens bei mehr als zehn bösartigen Tumoren gemeldet, darunter Cholangiokarzinom, Urothelkarzinom (20 %), Brustkrebs, Lungenkrebs, hepatozelluläres Karzinom und verschiedene solide Tumoren.
Im Januar 2016 wurde in einem in Clinical Cancer Research veröffentlichten Artikel die Sequenzierungstechnologie der nächsten Generation verwendet, um FGFR-Mutationen in 4.853 Patientenproben verschiedener Krebsarten nachzuweisen, einschließlich Amplifikationen, Mutationen und Umlagerungen. Unter den sequenzierten Proben beobachtete die Studie eine Gesamtinzidenzrate von FGFR-Mutationen von 7,1 %, wobei Genumlagerungen mit 8 % am wenigsten verbreitet waren [1].
Bei verschiedenen Krebsarten
Bisher können FGFR-Inhibitoren in drei Haupttypen eingeteilt werden: Tyrosinkinase-Inhibitoren (TKIs), monoklonale Antikörper (mAbs) und FGF-Ligandenfallen [2].
1. Tyrosinkinase-Inhibitoren (TKIs):
TKIs können weiter in Multi-Target-FGFR-Inhibitoren und selektive FGFR-Inhibitoren eingeteilt werden. Selektive FGFR-TKIs werden in drei Klassen eingeteilt:
A. Pan-FGFR-Inhibitoren: Diese Inhibitoren wirken effektiv gleichzeitig auf FGFR1 bis FGFR4.
B. FGFR1-3-Inhibitoren: Diese Inhibitoren zielen wirksam auf FGFR1 bis FGFR3 ab, haben jedoch eine schwache Hemmwirkung auf FGFR4.
C. FGFR4-Inhibitoren: Diese Inhibitoren haben eine schwächere Selektivität gegenüber FGFR1 bis FGFR3.
Erdafitinib war der erste weltweit zugelassene FGFR-Inhibitor und erhielt 2019 von der US-amerikanischen FDA die Zulassung zur Behandlung von Urothelkarzinomen. Die Ergebnisse der klinischen Phase-II-Studie BLC2001 (NCT02365597) zeigten vielversprechende Ergebnisse bei 99 Patienten mit Urothelkarzinom, das FGFR2/FGFR3-Veränderungen aufwies. Die Gesamtansprechrate (ORR) betrug 40 % (vollständiges Ansprechen [CR] 3 %, teilweises Ansprechen [PR] 37 %), mit einem mittleren progressionsfreien Überleben (PFS) von 5,5 Monaten und einem mittleren Gesamtüberleben (OS) von 5,5 Monaten 13,8 Monate. Diese positiven Ergebnisse führten dazu, dass Erdafitinib der erste von der FDA zugelassene orale selektive FGFR-Inhibitor wurde.
Nach Erdafitinib wurden anschließend Pemigatinib und Infigratinib für die Behandlung von Cholangiokarzinomen zugelassen, was das Forschungsinteresse an FGFR-TKIs weiter verstärkte. Da FGFR in verschiedenen Krebsarten exprimiert wird, werden FGFR-TKIs bei verschiedenen Krebsarten kontinuierlich erforscht.
Die Entwicklung von FGFR-Inhibitoren stellt einen bedeutenden Fortschritt bei gezielten Krebstherapien dar und bietet potenzielle Behandlungsmöglichkeiten für Patienten mit FGFR-veränderten Krebsarten. Während die Forschung in diesem Bereich weitergeht, besteht die Hoffnung, dass FGFR-Inhibitoren die Ergebnisse weiter verbessern und ihre Anwendungen auf mehrere Krebsarten ausweiten werden.
Forschung bei Magenkrebs
Im Kontext der Präzisionsonkologie dienen verschiedene neue potenzielle molekulare Signalwege als neue Ziele für die Arzneimittelentwicklung bei Magenkrebs. Eines dieser Ziele ist der Fibroblast Growth Factor Receptor (FGFR). Die folgende Abbildung zeigt die anatomische Verteilung und relative Häufigkeit von Subtypen aus dem Krebsgenomatlas (TCGA) im gesamten Magen. Die Tabelle enthält unterschiedliche molekulare und klinische Merkmale für jeden der vier Subtypen.
Molekulare und klinische Merkmale der TCGA-Subtypen von gastroösophagealem/gastroösophagealem Übergangskrebs (G/GEJ)[3]
Eine multizentrische, offene, einarmige Phase-IIa-Studie (NCT05019704) untersuchte die Wirksamkeit und Sicherheit von Infigratinib bei Patienten mit fortgeschrittenen soliden Tumoren, die zuvor mindestens zwei systemische Therapielinien erhalten hatten und eine FGFR2-Genamplifikation aufwiesen. Die Studie umfasste Patienten mit lokal fortgeschrittenem oder metastasiertem Magenkrebs oder Adenokarzinom des gastroösophagealen Übergangs (GEJ) mit FGFR2-Genamplifikation sowie anderen fortgeschrittenen soliden Tumoren mit anderen FGFR-Genveränderungen.
Die Studienergebnisse zeigten, dass bei den zuvor behandelten Patienten mit lokal fortgeschrittenem oder metastasiertem Magenkrebs oder GEJ-Adenokarzinom, die eine FGFR2-Genamplifikation aufwiesen, die objektive Ansprechrate (ORR) 25,0 % (n = 20) und die mittlere Ansprechdauer betrug (DOR) betrug 3,8 Monate [4].
Diese Ergebnisse deuten darauf hin, dass Infigratinib bei dieser speziellen Gruppe von Patienten mit fortgeschrittenem Magenkrebs und Krebs im gastroösophagealen Übergang, die eine FGFR2-Genamplifikation aufwiesen, ein gewisses Maß an Wirksamkeit zeigte. Es ist jedoch wichtig zu beachten, dass es sich um eine einarmige Studie handelte und weitere Untersuchungen, einschließlich randomisierter kontrollierter Studien, erforderlich sind, um die Wirksamkeit und Sicherheit des Arzneimittels bei einer größeren Population von Patienten mit ähnlichen genetischen Veränderungen zu bestätigen.
Erforschung hämatologischer Tumoren:
Am 26. August 2022 hat die US-amerikanische Food and Drug Administration (FDA) Pemazyre (Pemigatinib) für die Behandlung erwachsener Patienten mit rezidivierten oder refraktären myeloischen und lymphatischen Neoplasien (MLNs) mit FGFR1-Genumlagerungen zugelassen, basierend auf Daten aus FIGHT-203 Gerichtsverhandlung. Die Studie umfasste 28 Patienten mit rezidivierten oder refraktären MLNs mit FGFR1-Umlagerungen. Von den 18 Patienten mit chronischer myeloischer Phase mit oder ohne extramedulläre Erkrankung (EMD) erreichten 14 eine vollständige Remission (CR) (78 %), mit einer mittleren Zeit bis zur CR von 104 Tagen. Von den vier Patienten mit oder ohne EMD im Knochenmark erreichten zwei eine CR und von den drei Patienten mit EMD erreichte einer eine CR. Die vollständige zytogenetische Ansprechrate betrug insgesamt 79 %, darunter drei Patienten ohne morphologische Anzeichen [5].
Untersuchung bei Pan-Krebs:
Auf der Jahrestagung 2023 der AACR (American Association for Cancer Research) wurden Daten aus der Phase-II-Studie FIGHT-207 vorgestellt, die darauf hinweisen, dass Pemazyre Wirksamkeit und gute Verträglichkeit bei intensiv behandelten Patienten mit fortgeschrittenen/metastasierten oder inoperablen soliden Tumoren mit FGFR-Mutationen zeigte Fusionen/Umlagerungen, einschließlich Cholangiokarzinom, Tumoren des Zentralnervensystems (ZNS), gynäkologische Tumoren und Bauchspeicheldrüsenkrebs. Die Studienergebnisse zeigten, dass die objektive Ansprechrate (ORR) für Patienten mit FGFR-Fusionen oder -Umlagerungen (n = 49; Kohorte A) 26,5 % (95 %-KI: 15,0 %–41,1 %) betrug und die Krankheitskontrollrate (DCR) betrug 65,3 % (95 %-KI: 50,4 %–78,3 %). Bei Patienten mit umsetzbaren FGFR-Einzelnukleotidvarianten (SNVs) (n = 32; Kohorte B) betrug die ORR 9,4 % (95 %-KI: 2,0–25,0 %) und die DCR 56,3 % (95 %-KI: 37,7 %). -73,6 %). Bei Patienten mit Mutationen der FGFR-Kinasedomäne oder Mutationen unsicherer Signifikanz (n = 26; Kohorte C) betrug die ORR 3,8 % (95 %-KI: 0,1 %–19,6 %) und die DCR 34,6 % (95 %-KI: 17,2). %-55,7%) [6]. Somit zeigte Pemazyre eine breite Antitumoraktivität bei verschiedenen Krebsarten.
Zusammenfassung:
Es wurde festgestellt, dass FGFR an verschiedenen Prozessen der Krebsentstehung beteiligt ist, was es zu einem vielversprechenden Ziel für den „Pan-Cancer“-Behandlungsansatz macht. Derzeit haben Multi-Target-FGFR-Inhibitoren und drei selektive FGFR-Inhibitoren (Erdafitinib, Pemigatinib und Infigratinib) die FDA-Zulassung erhalten, was wahrscheinlich den Einsatz anderer selektiver FGFR-Inhibitoren im klinischen Umfeld vorantreiben wird.
Die klinische Anwendung von FGFR-Inhibitoren steht vor drei Hauptherausforderungen: der Entstehung erworbener Resistenzen, der Patientenauswahl und systemischen Nebenwirkungen. Um erworbene Resistenzen anzugehen, werden kovalente Inhibitoren, monoklonale Anti-FGFR-Antikörper und FGF-Ligandenfallen entwickelt, die auch systemische Nebenwirkungen reduzieren können. Kombinationstherapie und die Entwicklung einzelner Wirkstoffe mit zwei Zielen sind ebenfalls potenzielle Lösungen für erworbene Resistenzen [2].
Präzisionsmedizin steht derzeit im Mittelpunkt der Krebsbehandlung und die Patientenauswahl spielt bei der Krebstherapie eine entscheidende Rolle. Next-Generation-Sequencing (NGS) kann dazu beitragen, spezifische molekulare Defekte bei der Diagnose und dem Krankheitsverlauf zu erkennen und bei der Vorauswahl von Patientenpopulationen für klinische Studien zu helfen. Daher ist die Identifizierung geeigneter Biomarker bei Patienten zur Auswahl des am besten geeigneten FGFR-Inhibitors für optimale Wirksamkeit von entscheidender Bedeutung.
Verweise:
1. Clin Cancer Res. 1. Jan. 2016;22(1):259-67
2. Fortschritte in der gezielten Therapie von FGFR bei Krebs
3. Nat Rev Clin Oncol 2021 Aug;18(8):473-487
4. ClinicalTrials.gov-Kennung: NCT05019794
5. Offizielle Website der FDA
6. AACR-Jahrestagung 2023; 14.–19. April 2023; Orlando, FL. Zusammenfassung CT016
Haftungsausschluss: Dieser Text dient ausschließlich der Weitergabe und gibt nicht den Standpunkt der Plattform wieder. Wenn es Urheberrechts- oder andere Probleme gibt, kontaktieren Sie uns bitte umgehend. Wir werden das Problem so schnell wie möglich beheben. Danke schön!