Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Neues aus der Industrie
{{{sourceTextContent.title}}}
Die wichtige Rolle von PDGFRA in der Pathogenese von gastrointestinalen Stromatumoren (GISTs)
{{{sourceTextContent.subTitle}}}
Die wichtige Rolle von PDGFRA in der Pathogenese von gastrointestinalen Stromatumoren (GISTs)
{{{sourceTextContent.description}}}
Hintergrund:
Gastrointestinale Stromatumoren (GIST) sind gastrointestinale mesenchymale Tumoren, die in der Regel aus dem Verdauungstrakt stammen. Sie zeichnen sich durch ihre Morphologie aus und weisen typischerweise eine Positivität für CD117 (c-kit) auf. Aktivierungsmutationen der KIT- oder PDGFRA-Gene sind die Hauptursachen für die Entstehung von GIST. GIST treten am häufigsten im Magen auf (60 %), gefolgt von Dünndarm (Jejunum und Ileum, 30 %), Zwölffingerdarm (5 %), Rektum (2 bis 3 %) und Dickdarm (1 bis 2 %). Das Auftreten von GIST in der Speiseröhre ist sehr viel seltener (<1 %), und eine kleine Anzahl von GIST kann in extraintestinalen Bereichen wie dem Omentum major, Mesenterium, Becken und Retroperitoneum auftreten. Die meisten Studien berichten von einer jährlichen Inzidenzrate von GIST zwischen 10 und 15 Fällen pro Million. Die häufigsten Mutationen bei GISTs sind die des KIT-Gens und des PDGFRA-Gens. Das PDGFRA-Gen (Platelet-Derived Growth Factor Receptor Alpha) kodiert eine Rezeptor-Tyrosinkinase, die an die entsprechenden Liganden bindet und eine entscheidende regulatorische Rolle bei der Embryonalentwicklung, der Zellproliferation, dem Überleben und den Chemotaxisprozessen spielt.
Einführung in PDGFRA:
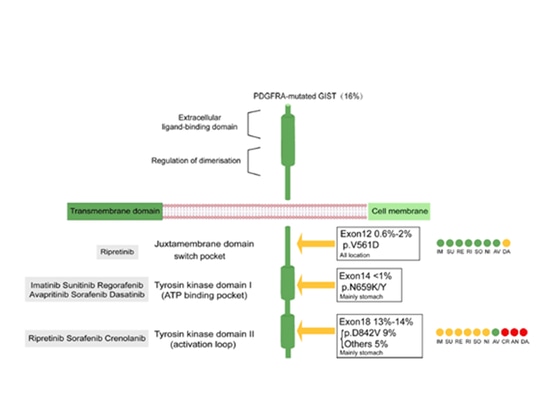
PDGF (Platelet-Derived Growth Factor) wurde ursprünglich im Prozess der Thrombozytenaktivierung entdeckt. Seine Rezeptoren, PDGFRA und PDGFRB, haben ähnliche Strukturen und werden während des Transports durch die Zellmembran intrazellulär aktiviert und sezerniert. PDGFR besteht aus einer extrazellulären ligandenbindenden Domäne, einer einzelnen Transmembranregion und einer intrazellulären Tyrosinkinasedomäne. Dieser duale Schaltermechanismus reguliert die Aktivität der zellulären Kinase präzise, indem er die Konformation der Kinase kontrolliert. Einerseits wird die Schaltersteuerung der Kinasekonformation durch die Phosphorylierung einer oder mehrerer Aminosäuren vermittelt, die die Kinase "ein-" oder "ausschalten" können. Die meisten primären und sekundären Resistenzmutationen in PDGFRA befinden sich in der Konformationskontrollschalterregion der intrazellulären Kinasedomäne. Primäre Mutationen finden sich häufig in der Aktivierungsschleife, während sekundäre Mutationen typischerweise in der ATP-Bindungsdomäne (Exon 14) oder der Aktivierungsschleife (Exon 18) auftreten. Mutationen in PDGFRA werden hauptsächlich in den Exons 18 und 12 und selten in Exon 14 beobachtet. Mutationen in Exon 18, das für die D842V-Stelle kodiert, machen etwa 80% der PDGFRA-Mutationen bei GIST aus. Abgesehen von der D842V-Mutation in Exon 18, die eine resistente Mutation darstellt, sind alle anderen Mutationen empfindlich gegenüber Imatinib. Studien haben ergeben, dass die D842V-Mutation im PDGFRA-Gen für die primäre Resistenz gegen Imatinib bei GIST-Patienten verantwortlich ist. PDGFRA-Mutationen sind unabhängig von C-KIT-Genmutationen. Daher kann die Untersuchung von Tumorpatienten auf PDGFRA-Genmutationen dazu dienen, die Wirksamkeit einer Imatinib-Behandlung zu bestimmen.
Abbildung 1: Übersicht über spezifische PDGFRA-Mutationen
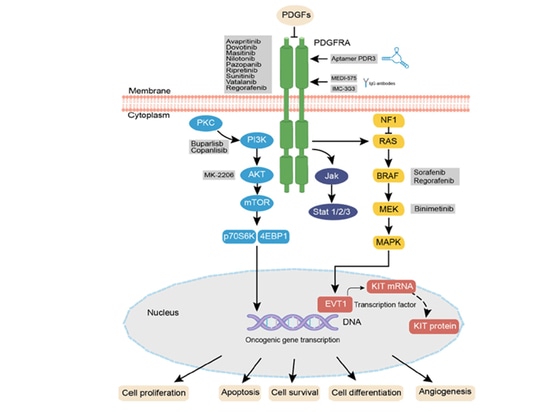
Der PDGFR-Signalweg ist ein wichtiger Rezeptor-Tyrosinkinase-Signalweg, der an den physiologischen Aktivitäten verschiedener Tumoren beteiligt ist [10]. Der PDGFR ist ein transmembranes Glykoproteindimer, das nach der Bindung an PDGF-Liganden eine Dimerisierung und Phosphorylierung auslöst und dadurch verschiedene nachgeschaltete Signalwege aktiviert, wie z. B. den Phosphoinositid-3-Kinase (PI3K)/Proteinkinase B (AKT/PKB)-Signalweg, den Mitogen-aktivierten Proteinkinase (MAPK)/Extrazelluläre Signal-regulierte Kinase (ERK)-Signalweg und den JAK-STAT-Signalweg [11-12]. Die Hemmung des PDGFR kann die Krebsausbreitung, Metastasierung, Invasion und Angiogenese verringern und die Antitumorwirkung von Krebsmedikamenten verbessern [13-14]. Derzeit werden mehrere therapeutische Strategien untersucht, die auf diesen Signalweg abzielen.
Abbildung 2: PDGFRA-Signalweg und aktuelle Therapiestrategien
Klinische Bedeutung
01. Bewertung des Behandlungsansprechens
Am 9. Januar 2020 erteilte die US-Arzneimittelbehörde FDA die Zulassung für Ayvakit (Avapritinib) zur Behandlung erwachsener Patienten mit inoperablen (nicht operativ entfernbaren) oder metastasierten (Krebszellen haben sich auf andere Körperteile ausgebreitet) gastrointestinalen Stromatumoren (GIST), die Exon-18-Mutationen des Plättchen-Wachstumsfaktor-Rezeptors alpha (PDGFRA) tragen, einschließlich des häufigsten Exon-18-Mutationstyps, PDGFRA D842V. Derzeit werden bei GIST häufig folgende Aminosäureveränderungen festgestellt:
02.Prognostische Bewertung:
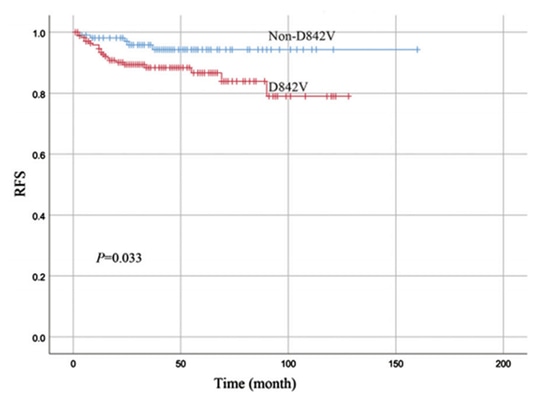
Forscher haben die prognostischen Unterschiede zwischen Patienten mit D842V-Mutation und Patienten ohne D842V-Mutation in PDGFRA-mutierten GISTs untersucht. Die Studie umfasste 280 Patienten, von denen 172 (61,4 %) die D842V-Mutation und 108 (38,6 %) die Nicht-D842V-Mutation aufwiesen. Die Studie ergab, dass die 1-Jahres-, 3-Jahres- und 5-Jahres-Überlebensraten ohne Rezidiv (RFS) für Patienten mit D842V-Mutation 94,6 %, 88,3 % bzw. 86,6 % betrugen, während die Raten für Patienten mit Nicht-D842V-Mutationen 98,1 %, 95,8 % bzw. 94,3 % betrugen. Patienten mit Nicht-D842V-Mutationen hatten eine bessere Prognose (P=0,033).
Abbildung 3: Unterschiedliche Prognosen bei PDGFRA-Mutationen an verschiedenen Stellen
Referenz:
[1] Poveda A, et al. GEIS guidelines for gastrointestinal sarcomas (GIST). Cancer Treat Rev. 2017;55:107-119.
[2] Søreide K, et al. Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies. Cancer Epidemiol. 2016;40:39-46.
[3] Fredriksson L, Li H, Eriksson U. The PDGF family: four gene products form five dimeric isoforms. Cytokine Growth Factor Rev (2004) 15(4):197-204.
[4] Kazlauskas A. PDGFs and their receptors. Gene (2017) 614:1-7.
[5] Heldin CH. Targeting the PDGF signaling pathway in tumor treatment. CellCommun Signal (2013) 11:97.
[6] Huse M, Kuriyan J. The conformational plasticity of protein kinases. Cell.(2002) 109(3):275-82.
[7] Cassier PA, Ducimetiere F, Lurkin A, Ranchere-Vince D, Scoazec JY, Bringuier PP, et al. A prospective epidemiological study of new incident GISTs during two consecutive years in Rhone alpes region: incidence and molecular distribution of GIST in a European region. Br J Cancer (2010) 103(2):165-70.
[8] Corless CL, Barnett CM, Heinrich MC. Gastrointestinale Stromatumoren: Entstehung und molekulare Onkologie. Nat Rev Cancer (2011) 11(12):865-78.
[9] Martin-Broto J, Martinez-Marin V, Serrano C, Hindi N, Lopez-Guerrero JA, Bisculoa M, et al. Gastrointestinal stromal tumors (GISTs): SEAP-SEOM-Konsens zur pathologischen und molekularen Diagnose. Clin Transl Oncol (2017) 19(5):536-45.
[10] Cavalcanti E, Ignazzi A, De Michele F, Caruso ML. PDGFRalpha-Expression als neuer therapeutischer Marker in gut differenzierten neuroendokrinen Tumoren. Cancer Biol Ther (2019) 20(4):423-30.
[11] Zou X, Tang XY, Qu ZY, Sun ZW, Ji CF, Li YJ, et al. Targeting the PDGF/PDGFR signaling pathway for cancer therapy: A review. Int J Biol Macromol (2022)202:539-57.
[12] Huang XL, Khan MI, Wang J, Ali R, Ali SW, Zahra QU, et al. Role of receptor tyrosine kinases mediated signal transduction pathways in tumor growth and angiogenesis-new insight and futuristic vision. Int J Biol Macromol (2021) 180:739-52.
[13] Thies KA, Hammer AM, Hildreth BE3rd, Steck SA, Spehar JM, Kladney RD,etal. Stromal platelet-derived growth factor receptor-beta signaling promotes breast cancer metastasis in the brain. Cancer Res (2021) 81(3):606-18.
[14] Balamurugan K, Koehler L, Durig JN, Hempel U, Rademann J, Hintze V,etal. Strukturelle Einblicke in die Modulation der PDGF/PDGFR-beta-Komplexierung.
[15]. Zhang P, Wang M, Li J, Gao X, Zhang B, Liang H, Zhou Y, Liao G, Feng F, Zhou Y, Yu J, Zhang J, Zhou Y, Ye Y, Chen J, Zhao Q, Shen K, Cao H, Tao K. Clinicopathologic Characteristics and Prognosis of PDGFRA-Mutant Gastrointestinal Stromal Tumors: Eine groß angelegte, multiinstitutionelle Beobachtungsstudie in China. Adv Ther. 2022 Jun;39(6):2920-2931.
[16] Chinese Society of Clinical Oncology Gastrointestinal Stromal Tumor Expert Committee, et al. "Consensus of Chinese Experts on Gene Testing and Clinical Application of Gastrointestinal Stromal Tumors (2021 Edition)." Chinese Journal of Clinical Oncology. 2021;26(10):920-927.
Haftungsausschluss: Dieser Artikel dient ausschließlich der Verbreitung und stellt nicht die Position der Plattform dar. Sollte es Urheberrechts- oder andere Probleme geben, kontaktieren Sie uns bitte sofort, und wir werden die notwendigen Korrekturen umgehend vornehmen. Wir danken Ihnen!