#Produkttrends
Neue therapeutische Ziele für epithelialen Eierstockkrebs
Eierstockkrebs stellt eine erhebliche Bedrohung für die Gesundheit von Frauen dar.
Weltweit ist es der achthäufigste bösartige Tumor bei Frauen und die tödlichste gynäkologische Malignität mit der höchsten Sterblichkeitsrate unter den drei wichtigsten gynäkologischen Tumoren (Eierstock-, Gebärmutterhals- und Endometriumkrebs) [1]. In China ist die Situation hinsichtlich der Prävention und Behandlung von Eierstockkrebs ebenso düster. Eierstockkrebs steht hinsichtlich der Inzidenz an dritter Stelle der drei größten gynäkologischen Tumoren und nimmt jährlich zu. Die Sterblichkeitsrate ist auch bei bösartigen Erkrankungen des weiblichen Fortpflanzungstrakts am höchsten [2]. Eierstockkrebs wird oft als „stiller Killer“ bezeichnet, da er tief im Becken lokalisiert ist und seine frühen Symptome oft verborgen bleiben. Zum Zeitpunkt der Diagnose befinden sich 70 % der Patienten bereits in einem fortgeschrittenen Stadium mit Becken- und Bauchausbreitung (Stadium III/IV) [3]. Unter den verschiedenen Arten von Eierstockkrebs ist das Epithelkarzinom die häufigste und macht etwa 80 % der bösartigen Eierstocktumoren aus [4]. Gemäß der WHO-Klassifikation von 2014 kann epithelialer Eierstockkrebs weiter in seröses Karzinom (70–80 %), Endometrioidkarzinom (10 %), klarzelliges Karzinom (10 %), muzinöses Karzinom (3 %) und andere seltene Typen eingeteilt werden (<5 %) [5].
Seröse Karzinome können weiter in hochgradige seröse Karzinome (HGSC) und niedriggradige seröse Karzinome (LGSC) unterteilt werden. HGSC macht etwa 70 % der Fälle von epithelialem Eierstockkrebs aus, während LGSC 5 % ausmacht [5]. HGSC ist die häufigste Form von Eierstockkrebs und zeichnet sich durch starke Invasivität und schlechte Prognose aus. Bei etwa 70 % der Patienten kommt es innerhalb von drei Jahren nach der Standardbehandlung (Operation + Chemotherapie) zu einem Rezidiv, und letztendlich sind viele aufgrund erworbener Arzneimittelresistenzen unheilbar [6]. In den letzten Jahren hat sich die Prognose von HGSC bei Patienten mit BRCA1/2-Mutationen durch den Einsatz von PARP-Inhibitoren deutlich verbessert. Mit der kontinuierlichen Aufklärung der molekularen Eigenschaften von Eierstockkrebs hat sich die Behandlung schrittweise in Richtung einer individualisierten Präzisionstherapie verlagert, und die Entwicklung und Anwendung gezielter Medikamente hat neue Hoffnung geweckt und den traditionellen Behandlungsansatz verändert.
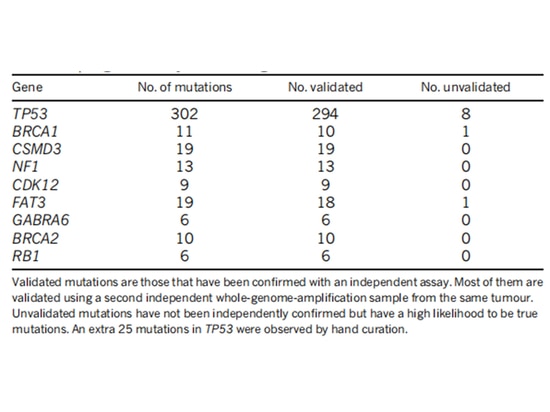
Das TCGA-Forschungsteam analysierte die mRNA-Expression, microRNA-Expression, Promotormethylierung, DNA-Kopienzahl und Exon-DNA-Sequenzierung kodierender Gene in 489 Fällen von hochgradigem serösem Adenokarzinom der Eierstöcke. Sie fanden heraus, dass fast alle Patienten mit hochgradigem serösem Eierstockkrebs TP53-Mutationen aufwiesen (96 %), gefolgt von BRCA1/2-Mutationen (häufig in Keimbahn- und somatischen Mutationen, die 22 % der Fälle ausmachten) [7] (Abbildung 1). Nach dem Auftreten von TP53-Mutationen geht die G1/S-Checkpoint-Funktion von Tumorzellen verloren. WEE1-Kinase kann den Zelleintritt in die Mitose am G2/M-Kontrollpunkt blockieren und beschädigte DNA reparieren, um die genomische Stabilität aufrechtzuerhalten [8] (Abbildung 2). Wird der G2/M-Zell-Checkpoint durch einen WEE1-Inhibitor entlastet, können die DNA-Schäden der Tumorzellen nicht repariert werden, was zu „synthetischer Letalität“ führt [8]. Daher sind WEE1-Inhibitoren zu potenziellen gezielten Therapeutika für TP53-mutierten epithelialen Eierstockkrebs geworden. Derzeit befindet sich nur Adavosertib (AZD1775/MK1775) in der klinischen Prüfung.
Kürzlich haben die in The Lancet veröffentlichten Ergebnisse einer klinischen Phase-II-Studie (NCT02151292) weltweite Aufmerksamkeit erregt. Die Studie umfasste 99 Patientinnen mit fortgeschrittenem, refraktärem, hochgradigem serösem Eierstockkrebs (d. h. Patientinnen, die gegenüber einer platinbasierten Chemotherapie resistent oder refraktär waren).
Im Verhältnis 2:1 erhielt die Versuchsgruppe (n=65) das Prüfpräparat Wee1-Inhibitor Adavosertib in Kombination mit einer Gemcitabin-Behandlung, während die Kontrollgruppe (n=34) Gemcitabin allein erhielt. Nach der Einschreibung brachen 5 Patienten aus anderen Gründen die klinische Studie ab und erhielten keine Behandlung. Bei den verbleibenden 94 behandelten Patienten betrugen die objektiven Ansprechraten 23 % in der Versuchsgruppe und 6 % in der Kontrollgruppe, was auf eine signifikante Verbesserung der objektiven Ansprechraten unter Adavosertib hinweist. Im Hinblick auf das Überleben verlängerte Adavosertib auch das mittlere progressionsfreie Überleben (mPFS) signifikant von 3,0 Monaten auf 4,6 Monate, wobei das Risiko einer Krankheitsprogression um 45 % reduziert wurde. Das mittlere Gesamtüberleben (mOS) erhöhte sich von 7,2 Monaten auf 11,4 Monate, was zu einer durchschnittlichen Verlängerung von 4,2 Monaten führte [9] (Abbildung 3, Abbildung 4). Die Studie zeigt den klinischen Nutzen des Wee1-Inhibitors in Kombination mit einer Chemotherapie.
Darüber hinaus zeigte eine randomisierte doppelblinde Phase-II-Studie (NCT01357161), dass Adavosertib in Kombination mit einer Carboplatin/Paclitaxel-Chemotherapie die therapeutische Wirksamkeit von platinempfindlichem Eierstockkrebs mit p53-Mutation steigern und so das progressionsfreie Überleben (PFS) (7,9 Monate) verbessern kann vs. 7,3 Monate). Es wurde beobachtet, dass Adavosertib einen moderaten klinischen Nutzen hat [10]. Eine weitere klinische Phase-II-Studie (NCT01164995) zeigte, dass Adavosertib die Wirksamkeit von Carboplatin bei p53-mutiertem Eierstockkrebs steigert, mit einer Gesamtansprechrate von 43 %, aber schließlich entwickelt sich eine Resistenz [11]. Eine klinische Phase-II-Studie (NCT02272790) zeigte klinische Vorteile von Adavosertib in Kombination mit einer Carboplatin-Therapie; Allerdings verursachte diese Kombinationsbehandlung im Vergleich zur Carboplatin-Monotherapie häufiger eine hämatologische Toxizität [12]. Daher ist zukünftige Forschung erforderlich, um die Behandlungsdosis und das Behandlungsschema für die Kombination von Adavosertib und Carboplatin zu optimieren.
PARP-Inhibitoren, die auf dem Prinzip der „synthetischen Letalität“ basieren, haben eine signifikante Wirksamkeit bei der Behandlung von Eierstockkrebs gezeigt. In ähnlicher Weise sind WEE1-Inhibitoren, die auf dem gleichen Prinzip basieren, zu einer attraktiven Option für epithelialen Eierstockkrebs geworden und haben eine gewisse Wirksamkeit bei anderen soliden Tumoren wie Endometriumkrebs, Plattenepithelkarzinomen im Kopf- und Halsbereich, kleinzelligem Lungenkrebs und Bauchspeicheldrüsenkrebs gezeigt. Der Mechanismus der Empfindlichkeit gegenüber WEE1-Inhibitoren bei Eierstockkrebs wird ebenfalls kontinuierlich untersucht. Untersuchungen haben gezeigt, dass der Aktivierungsstatus von mTOR die Empfindlichkeit von Krebszellen gegenüber der WEE1-Hemmung erheblich beeinflusst. Es wurde auch berichtet, dass Krebs mit H3K36me3-Defekten sehr empfindlich auf die WEE1-Hemmung reagiert. Ein Team unter der Leitung von Pan Chaoyun, Yao Shuzhong und Wang Wei von der Sun Yat-sen-Universität in China entdeckte, dass das ODF2L-Gen ein Schlüsselfaktor ist, der die Empfindlichkeit epithelialer Ovarialtumorzellen gegenüber der gezielten WEE1-Hemmung bestimmt. Die Kombination von ODF2L- und WEE1-Targeting zeigt synthetische Letalität [13].
Dem mutierten p53-Protein fehlen aufgrund seiner glatten Oberfläche geeignete Taschen für die Bindung von Verbindungen, was eine erhebliche Herausforderung bei der Arzneimittelentwicklung darstellt. Diese Eigenschaft hat TP53 neben RAS und MYC zu einem der drei wichtigsten „nicht behandelbaren“ Ziele gemacht. Allerdings gibt es derzeit zwei Medikamente auf dem Markt, die auf RAS abzielen, was die Vorstellung, dass es sich um eine „nicht medikamentöse“ Natur handelt, in Frage stellt. Es besteht die Hoffnung, dass das nächste Medikament, das auf dem Prinzip der synthetischen Letalität basiert, zugelassen und für mehr Patienten verfügbar gemacht werden kann.
Verweise:
[1] CA Cancer J Clin, 2021.
[2] Journal of the National Cancer Center, 2022, 2(1).
[3] NCCN Eierstockkrebs 2023 V1.
[4] Leitlinien zur Diagnose und Behandlung von Eierstockkrebs (Ausgabe 2022).
[5] Weißbuch zum Diagnose- und Behandlungsstatus von Eierstockkrebs in China (Ausgabe 2022).
[6] Fortschritte in der Anwendung der Präzisionsmedizin beim hochgradigen serösen Adenokarzinom des Eierstocks. Fudan Journal of Medical Sciences (Medizinische Ausgabe), 1-10.
[7] Nature, 2011, 474(7353): 609-615.
[8] Zellzyklus, 2013, 12(19): 3159-3164.
[9] Lancet, 23. Januar 2021; 397(10271): 281-292.
[10] Clinical Cancer Research, 2020, 26(18): 4767-4776.
[11] Journal of Clinical Oncology, 2016, 34(36): 4354-4361.
[12] Journal of Clinical Oncology, 2019, 37(15): S5513 [24.10.2021].
[13] Journal of Clinical Investigation, 2023; 133(2): e161544.