Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Produkttrends
{{{sourceTextContent.title}}}
Vergangenheit und Gegenwart der PARPis
{{{sourceTextContent.subTitle}}}
Vergangenheit und Gegenwart der PARPis
{{{sourceTextContent.description}}}
Im Jahr 2014 wurde der erste PARP-Inhibitor Olaparib (Olaparib) eingeführt. Dies ist das erste vermarktete Medikament nach dem Konzept der synthetischen Letalität, das einen neuen Weg für eine gezielte Tumortherapie eröffnete.
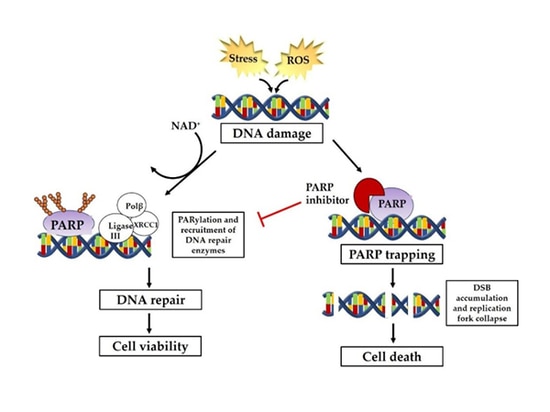
PARP-Inhibitoren und ihr Wirkmechanismus
Der vollständige Name der PARP-Inhibitoren lautet Polyadenosindiphosphat-Ribosepolymerase-Inhibitoren.
Im Jahr 1922 entdeckte Calvin Bridges, ein Genetiker, der im Morgan Laboratory der Columbia University arbeitete, dass es zum Tod von Drosophila führt, wenn zwei spezifische Gene in Drosophila gleichzeitig durch Mutation inaktiviert werden, während die Mutation in nur einem dieser beiden Gene keine tödlichen Schäden bei Drosophila verursacht. Die so genannte "synthetische Letalität" bedeutet, dass zwei Gene in einer Zelle, wenn eines von ihnen allein mutiert ist oder nicht funktioniert, nicht zum Zelltod führen; wenn aber beide mutiert sind oder nicht exprimiert werden können, führt dies zum Zelltod. Mit diesem Prinzip kann eine selektive Abtötung von Tumorzellen erreicht werden, ohne dass normale Körperzellen beeinträchtigt werden.
Im Jahr 2005 wurde in zwei Studien, die gleichzeitig in Nature veröffentlicht wurden, zum ersten Mal bestätigt, dass es eine synthetische tödliche Wirkung zwischen PARP-Inhibitoren und BRCA1/2-Mutationen gibt.
Zu den an der DNA-Reparatur beteiligten Stoffwechselwegen gehören vor allem die Einzelstrangbruchreparatur (SSBR) und die Doppelstrangbruchreparatur (DSBR). Zu den Reparaturmechanismen gehören hauptsächlich die homologe Rekombination (HR), die nicht-homologe Endverbindung (NHEJ), die Basen-Exzisionsreparatur (BER), die Nukleotid-Exzisionsreparatur (NER), die Mismatch-Reparatur (MMR) und die Translesionssynthese usw. Die DNA-Einzelstrangreparatur hängt von dem durch PARP vermittelten Reparaturweg ab. Wenn die Einzelstrang-DNA geschädigt ist, sammelt sich PARP an der Stelle des DNA-Einzelstrangbruchs und wird aktiviert, wodurch eine Reihe von Komplexen rekrutiert wird, die an der DNA-Reparatur teilnehmen. PARP-Inhibitoren hemmen die Aktivität des PARP-Zyms, so dass es nicht mehr funktioniert, indem es PAR-Polymere bildet, um Proteine anzuziehen, die mit der Reparatur von DNA-Schäden zusammenhängen. Die Reparatur durch homologe Rekombination (HRR) ist die bevorzugte Reparaturmethode für DNA-Doppelstrangbrüche. Patienten mit einem Mangel an homologer Rekombinationsreparatur (HRD), der durch HRR-Genmutationen, einschließlich BRCA-Mutationen in Krebszellen, Keimbahnmutationen, somatische Mutationen verwandter Gene, die durch homologe Rekombination repariert werden, epigenetische Inaktivierung und viele andere Faktoren verursacht wird, verlieren die Funktion zur Reparatur von DNA-Doppelstrangbrüchen, was dazu führt, dass sowohl die Einzelstrang- als auch die Doppelstrangreparatur von Krebszellen nicht durchgeführt werden kann, um synthetische Letalität zu erreichen.
Zugelassene PARP-Inhibitoren
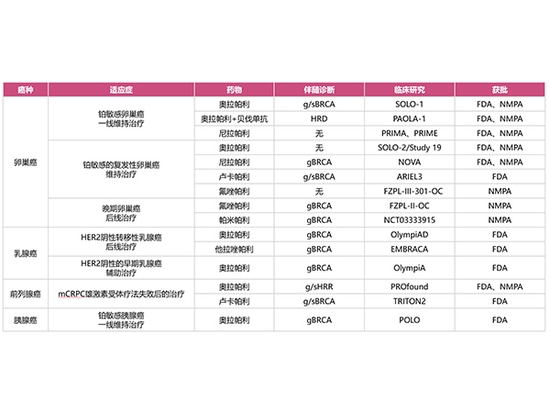
Derzeit hat die US-amerikanische FDA vier PARP-Inhibitoren (Olaparib, Niraparib, Rucaparib und Talazoparib) zugelassen, während die chinesische NMPA vier PARP-Inhibitoren (Olaparib, Niraparib, Fluzoparib, Pamiparib) zugelassen hat, die klinisch bei Eierstock-, Brust-, Bauchspeicheldrüsen- und Prostatakrebs eingesetzt wurden.
Von der FDA zugelassene Anwendungsgebiete:
Orapali:
Es wird zur Erhaltungstherapie von Patientinnen mit g/s BRCA-mutiertem fortgeschrittenem Eierstockkrebs eingesetzt, die nach einer platinbasierten Erstlinien-Chemotherapie eine CR/PR erreicht haben;
Für die Erhaltungstherapie von Patientinnen mit platinsensitivem rezidivierendem Eierstockkrebs, die nach einer platinbasierten Erstlinien-Chemotherapie eine CR/PR erreicht haben;
Für die Erhaltungstherapie in Kombination mit Bevacizumab bei Patientinnen mit HRD-positivem fortgeschrittenem Eierstockkrebs, die nach einer platinbasierten Erstlinien-Chemotherapie eine CR/PR erreicht haben;
Zur adjuvanten Therapie von erwachsenen Patientinnen mit gBRCA-mutiertem HER2-negativem Hochrisiko-Brustkrebs im Frühstadium, die eine neoadjuvante oder adjuvante Chemotherapie erhalten haben;
Zur Behandlung von erwachsenen Patientinnen mit gBRCA-mutiertem, HER2-negativem metastasiertem Brustkrebs, die eine neoadjuvante oder adjuvante Chemotherapie erhalten haben;
Für die Erhaltungstherapie von Patienten mit metastasiertem Adenokarzinom der Bauchspeicheldrüse, bei denen die platinbasierte Chemotherapie der Erstlinie seit mindestens 16 Wochen nicht fortgeschritten ist und die gBRCA-Mutationen aufweisen;
Zur Behandlung erwachsener Patienten mit metastasiertem kastrationsresistentem Prostatakrebs (mCRPC) mit g/s-HRR-Genmutation, bei denen nach der Behandlung mit Enzalutamid oder Abirateron vor der Stammtherapie eine Progression eingetreten ist.
Nirapali
Nirapali wird zur Erstlinien-Erhaltungstherapie von Patientinnen mit fortgeschrittenem Eierstockkrebs eingesetzt, die mit einer platinbasierten Erstlinien-Chemotherapie eine CR/PR erreicht haben;
Für die Erhaltungstherapie von platinsensiblen Patientinnen mit rezidivierendem Eierstockkrebs
Lucapali
Es wird zur Erhaltungstherapie von Patientinnen mit platinsensitivem rezidivierendem Eierstockkrebs eingesetzt;
Zur Behandlung erwachsener Patienten mit metastasiertem kastrationsresistentem Prostatakrebs (mCRPC), die zuvor eine auf den Androgenrezeptor gerichtete Therapie und eine Taxan-Chemotherapie erhalten haben und bei denen BRCA-Genmutationen vorliegen.
Talazoparib
Es wird zur Behandlung von Patienten mit lokal fortgeschrittenem oder metastasierendem Brustkrebs mit gBRCA-Mutation und HER2-negativem Tumor eingesetzt.
Von der NMPA zugelassene Anwendungsgebiete:
Orapali
Es wird zur Erhaltungstherapie von Patientinnen mit platinsensitivem rezidivierendem Eierstockkrebs eingesetzt;
Für die Erstlinien-Erhaltungstherapie von Patientinnen mit fortgeschrittenem Eierstockkrebs mit BRCA-Mutation;
Für die Erstlinien-Erhaltungstherapie in Kombination mit Bevacizumab bei Patientinnen mit neu diagnostiziertem fortgeschrittenem Eierstockkrebs, die nach einer platinbasierten Chemotherapie eine vollständige Remission oder Teilremission erreicht haben und HRD-positiv sind;
Für die Monotherapie erwachsener Patienten mit metastasiertem kastrationsresistentem Prostatakrebs, die BRCA1/2-Mutationen (Keimbahn und/oder somatisch) tragen und bei denen die Krankheit nach einer früheren Behandlung mit neuen Hormonpräparaten fortgeschritten ist.
Nirapali
Nirapali wird zur Erhaltungstherapie von Patientinnen mit platinsensitivem rezidivierendem Eierstockkrebs eingesetzt, nachdem mit einer platinhaltigen Chemotherapie eine vollständige oder partielle Remission erreicht wurde;
Für die Erstlinien-Erhaltungstherapie von Patientinnen mit fortgeschrittenem Eierstockkrebs, die auf eine platinhaltige Chemotherapie der Erstlinie vollständig oder teilweise angesprochen haben.
Fluzoparib
Es wird zur Behandlung von Patientinnen mit platinsensitivem rezidivierendem Ovarialkarzinom mit gBRCA-Mutation eingesetzt, die eine Chemotherapie in der Zweitlinie oder mehr erhalten haben;
Zur Erhaltungstherapie von Patientinnen mit platinsensitivem rezidivierendem Ovarialkarzinom nach vollständiger oder teilweiser Remission einer platinhaltigen Chemotherapie.
Pamipali
Es wird zur Behandlung von Patientinnen mit fortgeschrittenem Eierstockkrebs, Eileiterkrebs oder primärem Bauchfellkrebs eingesetzt, die mindestens zwei Chemotherapielinien erhalten haben und eine gBRCA-Mutation aufweisen.
Anwendbare Indikationen von der FDA zurückgezogen:
Mit der kontinuierlichen Aktualisierung der klinischen Forschung zeigen die klinischen Daten, dass das Sterberisiko von Eierstockkrebspatientinnen unter Lucaparib, Olaparib und Niraparib gestiegen ist, so dass die FDA einige der entsprechenden Indikationen zurückgezogen hat, von denen die Einschränkung der Indikationen für die Zweitlinien-Erhaltungstherapie mit Niraparib am auffälligsten ist, und auch die NCCN-Leitlinien wurden rechtzeitig angepasst, um die entsprechende Empfehlung zu streichen und den Empfehlungsgrad zu senken.
1. Im Juni 2022 zog die FDA die Zulassung von Rucaparib für die Zweitlinienbehandlung von Patientinnen mit BRCA-mutiertem Eierstockkrebs zurück.
2. Im August 2022 zog die FDA Olaparib für die Late-Line-Behandlung von Patientinnen mit fortgeschrittenem Eierstockkrebs mit BRCA-Mutationen zurück.
3. Im September 2022 zog die FDA Niraparib für die Late-Line-Behandlung von erwachsenen Patientinnen mit BRCA-Mutationen, HRD-positivem und platinsensitivem rezidivierendem epithelialem Eierstockkrebs, Eileiterkrebs oder primärem Peritonealkrebs zurück.
4. Im November 2022 zog die FDA einige Indikationen für die Erhaltungstherapie mit Niraparib für Patientinnen mit platinsensitivem rezidivierendem Eierstockkrebs zurück.
Im März 2021 zeigten die OS-Daten (Gesamtüberleben) einer NOVA-Studie, in der Niraparib als Erhaltungstherapie bei Patientinnen mit platinsensitivem rezidivierendem Eierstockkrebs eingesetzt wurde, dass bei Patientinnen mit Nicht-BRCA-Mutationen das mediane OS in der Niraparib-Gruppe 31,1 Monate betrug, verglichen mit 36,5 Monaten in der Kontrollgruppe, was bedeutet, dass es keinen OS-Vorteil durch die Niraparib-Erhaltungstherapie gibt. Im Endergebnis der NOVA-Studie lag die OS-Hazard-Ratio (HR) für Patienten mit Nicht-BRCA-Mutation bei 1,10 (95% CI: 0,831-1,459).
Im September 2022 veröffentlichte die American Society of Clinical Oncology (ASCO) die "PARP Inhibitor Ovarian Cancer Management: ASCO Guideline Rapid Recommendation Update", in der betont wird, dass bei Patientinnen mit nicht-BRCA-mutiertem rezidivierendem Eierstockkrebs eine Niraparib-Erhaltungstherapie zwischen dem potenziellen PFS-Vorteil (progressionsfreies Überleben) und der Verschlechterung des OS abgewogen werden muss.
Mit der Rücknahme der Teilindikationen für PARP-Inhibitoren ist es um die klinische Anwendung von PARP-Inhibitoren relativ ruhig geworden, und es besteht auch ein Bedarf an einer präzisen Anleitung zur Medikation.
Zusammenfassung
PARP-Inhibitoren sind zielgerichtete Medikamente, die durch den "synthetischen letalen" Effekt auf der Grundlage der HRD eine Anti-Tumor-Wirkung entfalten. Ihr Aufkommen hat das Behandlungsmodell des Ovarialkarzinoms verändert und die Erhaltungstherapie zu einem wichtigen Bestandteil der Gesamtbehandlung des Ovarialkarzinoms gemacht, was einen Meilenstein darstellt.
In der klinischen Praxis sollten die Indikationen für den Einsatz von PARP-Inhibitoren streng beachtet werden. Es wird empfohlen, vor der Medikation routinemäßig BRCA-Genmutationen nachzuweisen, und wenn es die Umstände erlauben, sollte ein HRD-Nachweis durchgeführt werden, um die klinische Medikation genau zu steuern und die Prognose zu bewerten.
Unter den Indikationen für PARP-Inhibitoren sind neben Brustkrebs, Eierstockkrebs, Eileiterkrebs usw. auch Prostatakrebs, der ebenfalls zu den reproduktiven Krebsarten gehört, von großem Forschungs- und Entwicklungseifer geprägt, und auch die Kombinationstherapie ist ein wichtiger Forschungsschwerpunkt. In Zukunft, wenn mehr klinische Studien abgeschlossen sind, werden die klinischen Anwendungsszenarien von PARP-Inhibitoren und verwandten molekularen Markern immer deutlicher werden.
referenzen:
1. Leitlinien für die klinische Anwendung von PARP-Inhibitoren bei Eierstockkrebs (Ausgabe 2022)
2. Nature. 2012 Jan 18;481(7381):287-94.
3. J Clin Med. 2019 Mar 30;8(4):435.
4. Offizielle Website der FDA
5. Offizielle Website der NMPA
6. NCCN-Richtlinien

{{medias[54624].description}}