Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Neues aus der Industrie
{{{sourceTextContent.title}}}
Aspartam: Eine süße Falle oder ein gesundheitliches Minenfeld?
{{{sourceTextContent.subTitle}}}
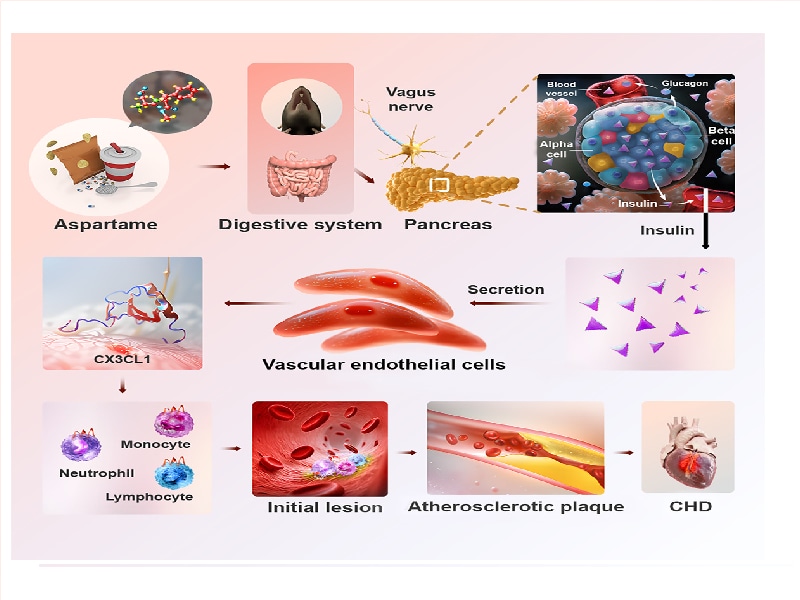
Die Forschung zeigt, dass Aspartam den Insulinspiegel über den Vagusnerv erhöht, die Atherosklerose verschlimmert und die Ausschaltung von Cx3cr1 ein neues Therapieziel darstellt.
{{{sourceTextContent.description}}}
Vor kurzem hat das Forschungsteam unter der Leitung von Akademiemitglied Cao Yihai vom Karolinska-Institut in Schweden mit den Teams der Akademiemitglieder Zhang Yun, Zhang Cheng und Dekan Chen Yuguo vom Qilu-Krankenhaus der Universität Shandong zusammengearbeitet. Sie veröffentlichten eine Forschungsarbeit mit dem Titel "Sweetener aspartame aggravates atherosclerosis through insulin-triggered inflammation" in der Zeitschrift Cell Metabolism. Diese Studie weist darauf hin, dass Aspartam das Auftreten von Atherosklerose verschlimmern und das Risiko von Herz-Kreislauf-Erkrankungen erhöhen kann. Obwohl künstliche Süßstoffe (wie Aspartam) die Zuckeraufnahme begrenzen und die Energiespeicherung verringern können, warum verursachen sie dann Herz-Kreislauf-Erkrankungen, die mit der Fettansammlung zusammenhängen?
Hintergrund der Forschung
Im Juli 2023 stufte die Weltgesundheitsorganisation Aspartam, einen der gebräuchlichsten künstlichen Süßstoffe, als krebserregend der Gruppe 2B ein, was einst in allen Bereichen große Besorgnis über künstliche Süßstoffe auslöste. Natürlich bedeutet Gruppe 2B nur, dass es für den Menschen möglicherweise krebserregend ist, und die Beweise für seine Karzinogenität beim Menschen sind begrenzt, so dass kein Grund zu übermäßiger Panik besteht. Abgesehen von Krebs werden jedoch immer wieder Zusammenhänge zwischen künstlichen Süßungsmitteln und anderen Krankheiten festgestellt.
Ziele der Forschung
Ziel dieser Studie ist es, den Zusammenhang zwischen künstlichen Süßungsmitteln, insbesondere Aspartam, und Herz-Kreislauf-Erkrankungen zu untersuchen. Sie konzentriert sich auf die Analyse der spezifischen molekularen Mechanismen, durch die APM die Atherosklerose beeinflusst, und liefert damit eine theoretische Grundlage und potenzielle therapeutische Ziele für die Prävention und Behandlung von Herz-Kreislauf-Erkrankungen.
Abbildung 1: Spezifische molekulare Mechanismen, durch die APM die Atherosklerose beeinflusst
Experimentelle Methoden
Mausmodelle: ApoE-/- Mäuse und Cx3cr1 MΦ-/-/ApoE -/- Doppelknockout-Mäuse, die alle mit einer fett- und cholesterinreichen Diät (HFCD) gefüttert wurden
Cynomolgus-Affen-Modell: Es wurden vierjährige männliche Cynomolgus-Affen verwendet. Ihrem Trinkwasser wurde APM oder Saccharose zugesetzt, um das Szenario der menschlichen Aufnahme von Süßungsmitteln zu simulieren. Die Veränderungen von Indikatoren wie Insulin, Glukose und C-Peptid im Blut wurden ermittelt, um zu überprüfen, ob die im Mausmodell festgestellte Wirkung von APM auf die Insulinsekretion auch bei Primaten auftritt, wodurch die Zuverlässigkeit und Universalität der Forschungsergebnisse erhöht wird.
Technische Mittel
Technologie der Genbearbeitung: Technologien wie CRISPR-Cas9 wurden eingesetzt, um genveränderte Mausmodelle zu konstruieren. So wurden beispielsweise LoxP-Stellen auf beiden Seiten des Cx3cr1-Gens eingefügt und dann mit Lyz2-Cre-Mäusen gekreuzt, um das Cx3cr1-Gen in Monozyten/Makrophagen auszuschalten und seine Funktion zu untersuchen.
Molekularbiologische Techniken: RNA-Sequenzierung wurde verwendet, um das Genexpressionsprofil von insulinstimulierten PAECs zu analysieren, um potenzielle Signalmoleküle zu finden; qPCR wurde verwendet, um die mRNA-Spiegel spezifischer Gene (wie Cx3cl1) zu messen; Western Blot wurde verwendet, um die Expression verwandter Proteine (wie CX3CL1 und CX3CR1) nachzuweisen, um die Veränderungsmuster verwandter Moleküle zu untersuchen, wenn APM die Atherosklerose beeinflusst.
Zellbiologische Techniken: Die primäre Zellkulturtechnik wurde zur Isolierung und Kultivierung von Maus-PAECs und primären Makrophagen für In-vitro-Studien von Zell-Zell-Interaktionen und Signaltransduktion verwendet. Mit Hilfe von Experimenten in parallelen Plattenflusskammern und Boyden-Kammern wurden die Adhäsion zwischen Monozyten und Endothelzellen sowie die Migrationsfähigkeit von Monozyten untersucht, um die Auswirkungen des CX3CL1-CX3CR1-Signalwegs auf die Zellfunktionen zu erforschen.
Metabolische Nachweistechniken: Das Tier-Energiestoffwechsel-Detektionssystem wurde verwendet, um die Parameter des Atmungsstoffwechsels von Mäusen zu messen, einschließlich des Sauerstoffverbrauchs, der Kohlendioxidproduktion, der Wärmeproduktion usw., um die allgemeine metabolische Wirkung von APM auf Mäuse zu bewerten; der Glukosetoleranztest (GTT) und der Insulintoleranztest (ITT) wurden verwendet, um die Insulinsensitivität von Mäusen zu ermitteln und festzustellen, ob APM zu Insulinresistenz führt.
Einzelzell-Sequenzierung: Sie wurde verwendet, um die Populationseigenschaften und Genexpressionsunterschiede von peripheren Blutmonozyten (PBMCs) in Cx3cr1 lox/lox und Cx3cr1 MΦ-/- Mäusen zu analysieren, um ein tieferes Verständnis der Veränderungen und Wirkungsmechanismen verschiedener Zellpopulationen während des Prozesses der APM mit Auswirkungen auf die Atherosklerose zu gewinnen.
Experimentelle Ergebnisse
1. APM verschlimmert die Atherosklerose bei Mäusen:
Nach 12-wöchiger Fütterung von ApoE-/- Mäusen mit verschiedenen Dosen von APM nahmen die atherosklerotischen Plaques (AP) in der Aorta der mit APM gefütterten Gruppe signifikant zu und zeigten eine dosisabhängige Beziehung. Das Zeitverlaufsexperiment zeigte, dass die Zahl der atherosklerotischen Läsionen und die durchschnittliche Plaquegröße zunahmen, wenn die Mäuse 4 Wochen lang mit APM gefüttert wurden, und dass sie nach 8 und 12 Wochen weiter zunahmen. Die Kontrollgruppe, die mit 15 % Saccharose gefüttert wurde, zeigte nach 4 und 8 Wochen keine offensichtliche Entwicklung von APs, und die fördernde Wirkung trat erst nach 12 Wochen auf. Die Fütterung mit APM hatte keinen Einfluss auf das Körpergewicht, die Zusammensetzung der Fettmasse, die Nahrungsaufnahme und die meisten Stoffwechselparameter der Mäuse. Lediglich die Fütterung mit Saccharose führte zu einem leichten Anstieg des Körpergewichts und der Fettmasse der Mäuse, und der LDL-Wert im Serum sank leicht.
Abbildung 2: APM verschlimmert die Atherosklerose bei Mäusen
2. APM erhöht den Plasmainsulinspiegel und reguliert das Insulin über den Vagusnerv: Mäuse:
Nach der Fütterung von Mäusen mit verschiedenen APM-Konzentrationen stiegen die Plasmainsulinspiegel innerhalb von 30 Minuten deutlich an. Die kontinuierliche Fütterung mit 0,15 % APM über 12 Wochen führte zu einem kontinuierlichen Anstieg des Seruminsulinspiegels, und die Mäuse entwickelten eine Insulinresistenz. Das Experiment mit dem Cynomolgus-Affen zeigte auch, dass nach einer 10-minütigen Fütterung mit 0,15 % APM oder 15 % Saccharose der Insulinspiegel nach 30 Minuten vorübergehend anstieg und nach 60 Minuten wieder auf den Normalwert zurückkehrte, und dass die Insulinspiegel in der APM-Gruppe und der Saccharose-Gruppe ähnlich waren, aber die Veränderungen des Blutzuckerspiegels waren entgegengesetzt. Die bilaterale subdiaphragmatische Vagotomie (SDV) konnte die Insulinproduktion und die durch APM induzierte Atherosklerose vollständig hemmen.
Abbildung 3: APM erhöht den Plasmainsulinspiegel und reguliert Insulin über den Vagusnerv
3. Mechanistische Untersuchung der insulinabhängigen Atherosklerose:
Implantation einer Insulin freisetzenden Mikropumpe in ApoE-/- Mäuse, um den Anstieg des zirkulierenden Insulinspiegels beim Menschen zu simulieren. Nach 4 Wochen waren die Bildung, das Wachstum und die Instabilität von APs verschlimmert, was dem Effekt der APM-Fütterung ähnelte. Die Verwendung von Streptozotocin (STZ) zur Ausschaltung der Insulinproduktion der Bauchspeicheldrüse konnte der verstärkten Bildung, dem Wachstum und der Instabilität von APs, die durch APM verursacht wurden, vollständig entgegenwirken, was zeigt, dass die Hochregulierung von Insulin eine notwendige Voraussetzung dafür ist, dass APM die Atherosklerose verschlimmert.
Abbildung 4: Mechanistische Untersuchung der insulinabhängigen Atherosklerose
4. CX3CL1 ist ein insulinstimuliertes arterielles endotheliales Chemokin:
Nachdem primäre Aortenendothelzellen (PAECs) 8 Stunden lang durch Insulin stimuliert wurden, zeigte die RNA-seq-Analyse, dass Cx3cl1 das am stärksten hochregulierte Gen war, und qPCR und Western Blot bestätigten die hohe Expression seiner mRNA und seines Proteins. In-vivo-Experimente zeigten, dass die Spiegel von zirkulierendem CX3CL1 und membrangebundenem CX3CL1 in Mäusen, die mit APM gefüttert wurden, signifikant anstiegen, und dass dieser Anstieg insulinabhängig war.
Abbildung 5: CX3CL1 ist ein insulinstimuliertes arterielles endotheliales Chemokin
5. Chemotaktische und adhäsive Effekte von CX3CL1-CX3CR1 auf Monozyten/Makrophagen:
In RAW264.7-Monozyten wurde das CX3CR1-Protein stark exprimiert. Das Ausschalten von CX3CR1 mit shRNA konnte die Adhäsion von insulinverstärkten Monozyten an PAECs hemmen. Das Parallelplatten-Durchflusskammerexperiment zeigte, dass die Insulinstimulation von PAECs die Adhäsion von Monozyten erhöhen konnte, und das Knocken von CX3CR1 konnte diesen Effekt hemmen. Darüber hinaus konnte der CX3CL1-CX3CR1-Signalweg auch die Migration von Monozyten und die Polarisierung von M0-Makrophagen in M1-Makrophagen induzieren.
Abbildung 6: Chemotaktische und adhäsive Effekte von CX3CL1-CX3CR1 auf Monozyten/Makrophagen
6. Die Deletion des Cx3cr1-Gens reduziert die proinflammatorische myeloische Zellpopulation:
Bei der Konstruktion von Cx3cr1 MΦ-/- Mäusen zeigte die Einzelzell-RNA-Sequenzierungsanalyse (scRNA-seq), dass die myeloische Zellpopulation signifikant reduziert war, die Subpopulationen der Monozyten/Makrophagen veränderten sich, die Mono-c1-Subpopulation nahm ab und die Mono-c3- und Makro-c5-Subpopulationen nahmen zu. Die Pseudo-Zeit-Analyse zeigte, dass die CX3CL1-CX3CR1-Signalachse die Monozytendifferenzierung beeinflusste.
Abbildung 7. scRNA-seq von PBMCs in Cx3cr1MΦ-/- Mäusen
7. Der Verlust der Funktion des Cx3cr1-Gens in Monozyten/Makrophagen wirkt der durch APM verstärkten Atherosklerose entgegen:
Im Vergleich zur Kontrollgruppe waren die verstärkte Bildung und das Wachstum von APs, die durch APM verursacht wurden, bei Cx3cr1 MΦ-/-/ApoE -/- Doppelknockout-Mäusen vollständig rückgängig gemacht. In der frühen Phase (4 Wochen) der AP-Entwicklung hemmte die Deletion des Cx3cr1-Gens die Läsionsbildung signifikant, und die anti-atherosklerotische Wirkung war nach 8 und 12 Wochen noch deutlicher.
Abbildung 8. Genetischer Funktionsverlust von Cx3cr1 in Monozyten/Makrophagen neutralisiert die durch APM verschlimmerte Atherosklerose
Schlussfolgerung der Forschung
Die Studie ergab, dass Aspartam durch Aktivierung des Parasympathikus den Insulinspiegel erhöhen und dadurch die Atherosklerose verschlimmern kann. Dieser Prozess ist insulinabhängig und beinhaltet den CX3CL1-CX3CR1-Signalweg.
Das Ausschalten des Cx3cr1-Gens in Monozyten/Makrophagen kann der durch Aspartam verstärkten Atherosklerose entgegenwirken und damit ein neues Ziel für die Behandlung der damit verbundenen Herz-Kreislauf-Erkrankungen bieten.
In dieser Studie wurde das Tier-Energiestoffwechselsystem zur Überwachung des Sauerstoffverbrauchs, der Kohlendioxidproduktion, der Wärmeproduktion und anderer Indikatoren von Mäusen verwendet, was wichtige Daten für die Erforschung des Zusammenhangs zwischen Aspartam und Atherosklerose lieferte und zeigt, dass die Überwachung des Energiestoffwechsels eine wichtige Rolle in der biowissenschaftlichen Forschung spielt.
Unser Unternehmen, Tow-Int Tech, hat unabhängig ein System zur Erfassung des Energiestoffwechsels bei Tieren entwickelt, das zur Echtzeit-Überwachung und Aufzeichnung von metabolischen und motorischen Indikatoren bei Kleintieren verwendet werden kann und mit dem die Verhaltensaktivitäten von Tieren und ihre Wechselwirkungen mit dem Atemstoffwechsel qualitativ und quantitativ gemessen und analysiert werden. Zu den ermittelten Indikatoren gehören Sauerstoffverbrauch, CO2-Produktion, RER-Atmungsaustauschverhältnis, EE-Energieverbrauch, Nahrungsaufnahme, Wasseraufnahme, dreidimensionale XYZ-Bewegung, Körpergewicht, Laufradaktivität und andere Indikatoren.
Referenzen:
[1] Wu W, Sui W, Chen S, et al. Süßstoff Aspartam verschlimmert Atherosklerose durch Insulin-ausgelöste Entzündung[J]. Cell Metabolism, 2025.
Kontaktieren Sie uns jetzt!
Wir setzen uns dafür ein, Ihre Forschung einfacher, genauer und effizienter zu machen und Ihnen zu helfen, Vertrauen in Ihre Daten aufzubauen! Wir haben bereits für eine Vielzahl von Kunden Dienstleistungen erbracht und verfügen über reiche Erfahrungen im Angebot maßgeschneiderter, professioneller Lösungen für Ihre Bedürfnisse.





