Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Neues aus der Industrie
{{{sourceTextContent.title}}}
Anwendung von Systemen zur Überwachung des Energiestoffwechsels in Mausmodellen mit Fettleber
{{{sourceTextContent.subTitle}}}
Metabolism System kann in Mausmodellen für Fettleber verwendet werden.
{{{sourceTextContent.description}}}
Fettleberkrankheit und ihr Zusammenhang mit Fettleibigkeit
Eine Fettleber steht in engem Zusammenhang mit Fettleibigkeit und geht häufig mit Stoffwechselstörungen wie Insulinresistenz und Dyslipidämie einher. Adipositas, insbesondere viszerale Adipositas, ist einer der Hauptrisikofaktoren für die mit Stoffwechselstörungen assoziierte Fettlebererkrankung (Metabolic Dysfunction-Associated Fatty Liver Disease, MAFLD). Daher ist die Entwicklung geeigneter Tiermodelle für die Fettleber von entscheidender Bedeutung für eingehende Studien zur Pathogenese der MAFLD und für die Erforschung potenzieller therapeutischer Strategien.
Unterschiede im Energiestoffwechsel in Fettleber-Mausmodellen
Mausmodelle für Fettleber (in der Regel durch fettreiche Diäten induziert), fettleibige Mausmodelle und normale Kontrollmäuse weisen erhebliche Unterschiede im Energiestoffwechsel auf. Diese Unterschiede spiegeln sich in erster Linie im Sauerstoffverbrauch (VO₂), in der Kohlendioxidproduktion (VCO₂), im Atmungsaustauschverhältnis (RER), im Energieaufwand (EE) und im Aktivitätsniveau wider. In den folgenden Abschnitten wird auf jeden dieser Parameter eingegangen:
1. Sauerstoffverbrauch (VO₂) und Kohlendioxydproduktion (VCO₂)
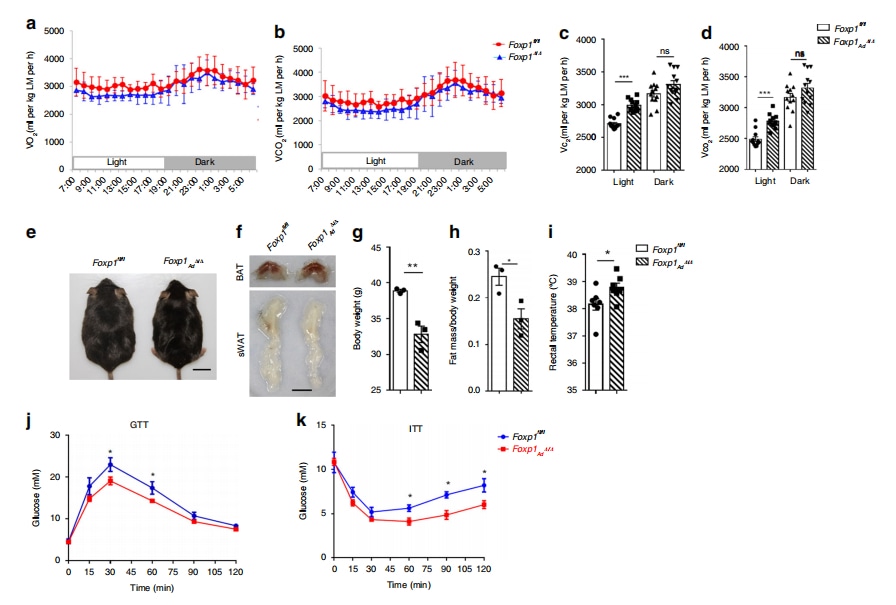
Fettleber/fettleibige Modellmäuse vs. Kontrollgruppe: Fettleber- und fettleibige Modellmäuse weisen in der Regel einen niedrigeren VO₂- und VCO₂-Wert auf. In einer Studie wurde beispielsweise festgestellt, dass die Deletion des Foxp1-Gens zu einer erhöhten Aktivität des braunen Fettgewebes, einem erhöhten Energieverbrauch und einer Resistenz gegen Fettleibigkeit durch fettreiche Ernährung führt (Liu et al., 2019). Wie in Abbildung 1 dargestellt, hatten Foxp1-Knockout-Mäuse (Foxp1-/-) einen höheren Sauerstoffverbrauch als Foxp1⁺/⁺-Mäuse (Liu et al., 2019).
Langfristige fettreiche Ernährung beeinträchtigt die Funktion der Mitochondrien und den Energiestoffwechsel, wodurch der Sauerstoffverbrauch sinkt. Studien zeigen, dass fettreiche Diäten die Atmungsfunktion verändern und die zirkadianen Rhythmen bei Mäusen beeinflussen (Wu et al., 2024).
Spexin moduliert den Energiestoffwechsel durch Erhöhung des Sauerstoffverbrauchs. In einer Studie wurde nachgewiesen, dass Spexin die Bräunung des weißen Fettgewebes über den JAK2-STAT3-Stoffwechselweg fördert und so die mit Fettleibigkeit verbundenen Stoffwechselstörungen verbessert (Zeng et al., 2024).
2. Austauschverhältnis der Atemwege (RER)
Definition:
Der RER ist das Verhältnis von Kohlendioxidproduktion zu Sauerstoffverbrauch und spiegelt die Art des verstoffwechselten Substrats wider. Ein RER nahe 1 deutet auf eine Kohlenhydratverwertung hin, während ein RER nahe 0,7 auf eine Fettverwertung hindeutet.
Fettleber-/Fettleibigkeitsmodell-Mäuse im Vergleich zur Kontrollgruppe: Diese Mäuse haben in der Regel einen niedrigeren RER-Wert, was auf eine stärkere Abhängigkeit von Fett als Energiequelle hinweist (Liu et al., 2019). In derselben Studie zeigt Abbildung 1, dass die RER-Werte in Foxp1-defizienten Mäusen niedriger waren als in der Kontrollgruppe, was auf einen verbesserten Fettstoffwechsel aufgrund der Foxp1-Deletion hindeutet.
3. Energieaufwand (EE)
Fettleber/Fettleibigkeit-Modellmäuse im Vergleich zur Kontrollgruppe: Obwohl diese Modelle niedrigere RER-Werte aufweisen, ist ihr EE nicht notwendigerweise reduziert und hängt von verschiedenen Faktoren wie Aktivitätsniveau, Nahrungsaufnahme und metabolischer Anpassung ab.
Einfluss der Temperatur:
Die Umgebungstemperatur beeinflusst die EE erheblich. Studien zeigen, dass Mäuse mehr Energie verbrauchen, um ihre Körpertemperatur bei normaler Raumtemperatur zu halten (John et al., 2022).
4. Aktivitätsniveau
Fettleber/fettleibige Modellmäuse vs. Kontrollgruppe: Mäuse mit Fettleber und fettleibige Mäuse haben in der Regel ein niedrigeres Aktivitätsniveau, möglicherweise aufgrund von Gewichtszunahme, Insulinresistenz und Entzündungen.
Freiwillige Bewegung kann den hepatischen Immunphänotyp modulieren und Stoffwechselparameter verbessern (Gehrke et al., 2019).
5. Zusammenfassung
Zusammenfassend lässt sich sagen, dass Fettleber- und fettleibige Mausmodelle im Allgemeinen einen geringeren Sauerstoffverbrauch, eine geringere RER, einen variablen Energieverbrauch und eine geringere körperliche Aktivität aufweisen. Diese Indizes werden jedoch von zahlreichen Faktoren wie der Zusammensetzung der Nahrung, dem genetischen Hintergrund, der Umgebungstemperatur und den Versuchsbedingungen beeinflusst. Bei C57BL/6J-Mäusen zum Beispiel ist die Dauer der Ernährungsintervention entscheidend. Marvyn et al. (2016) berichteten, dass eine kurzfristige (3-tägige) fettreiche Fütterung die Fettoxidation erhöht, während eine langfristige Fütterung zu anderen Stoffwechselergebnissen führt.
Beim Vergleich des Energiestoffwechsels zwischen verschiedenen Gruppen ist es daher wichtig, all diese Variablen zu berücksichtigen und eine strenge statistische Analyse durchzuführen.
Breitere Bedeutung des Stoffwechselsystems
Neben der Aufklärung der Stoffwechselmerkmale der Fettleber sind die Energiestoffwechselsysteme bei Tieren auch in folgender Hinsicht von Bedeutung:
Bewertung des Fortschreitens der Fettleber
Frühzeitige Erkennung: Stoffwechselveränderungen gehen den histologischen Leberveränderungen oft voraus. Die Überwachung des Energiestoffwechsels kann eine Früherkennung und rechtzeitige Intervention ermöglichen.
Krankheitsüberwachung: Die kontinuierliche Verfolgung von Stoffwechselparametern kann ein Fortschreiten oder eine Verbesserung der Krankheit aufzeigen und so zu therapeutischen Anpassungen beitragen.
Verständnis der Pathogenese
Störungen des Glukose- und Lipidstoffwechsels: Durch die Analyse von Stoffwechseldaten können Forscher die Rolle der Insulinresistenz, der Lipidsynthese und der Lipolyse bei der Pathogenese der Fettleber untersuchen.
Oxidativer Stress und Entzündungen: Eine Fettleber geht häufig mit oxidativem Stress und Entzündungen einher. Die Kombination von Stoffwechseldaten mit anderen biochemischen Daten kann zur Klärung dieser Zusammenhänge beitragen.
Bewertung von Therapiestrategien
Wirksamkeit von Arzneimitteln: Anhand von Stoffwechselsystemen kann bewertet werden, wie Medikamente den Energiestoffwechsel in Tiermodellen beeinflussen. So können beispielsweise Veränderungen von RER und EE anzeigen, ob ein Medikament die Stoffwechselfunktion verbessert.
Ernährungsspezifische Interventionen: Studien über verschiedene Diäten (z. B. fettreich oder kohlenhydratarm) und ihre metabolischen Auswirkungen können über evidenzbasierte Ernährungsstrategien informieren.
Vorhersage von Krankheitsrisiko und -prognose
Risikobewertung: Stoffwechselmarker wie z. B. ein erhöhter RER-Wert können auf ein erhöhtes Fettleberrisiko hinweisen und helfen, Risikopersonen frühzeitig zu erkennen.
Prognostische Bewertung: Anhaltende Stoffwechselstörungen können das Fortschreiten der Krankheit und schlechte Ergebnisse vorhersagen.
Synchronisierte Datenaufzeichnung und -analyse zur Gewährleistung der Datengenauigkeit und -sicherheit
Förderung der Grundlagen- und translationalen Forschung
Mechanistische Einblicke: Tierstudien zum Energiestoffwechsel vertiefen das Verständnis der Pathologie der Fettleber und unterstützen die Entwicklung klinischer Hypothesen.
Translationale Anwendungen: Erkenntnisse aus Tiermodellen können in die klinische Forschung einfließen und so die Entwicklung neuer Diagnoseinstrumente und Therapien beschleunigen.
Die Einhaltung ethischer und sicherheitstechnischer Vorschriften gewährleistet das Wohlergehen von Tieren und menschlichen Teilnehmern
System zur Überwachung des Energiestoffwechsels bei Tieren
Eines der grundlegenden Merkmale des Lebens ist der aktive Energiestoffwechsel - die ständige Aufnahme und der Verbrauch von Energie. Bei Säugetieren stammt die meiste Energie aus der Oxidation von drei Makronährstoffen: Kohlenhydrate, Fette und Proteine.
Das von Tawang Technology unabhängig entwickelte Animal Energy Metabolism Monitoring System schätzt die Energieproduktion durch Analyse des Sauerstoff-Kohlendioxid-Austauschs während des Stoffwechsels. Durch Auswertung des Sauerstoffverbrauchs (O₂) und der Kohlendioxidproduktion (CO₂) bestimmt das System den Energiegehalt der aufgenommenen Nahrung. Es unterstützt auch die Überwachung mehrerer Parameter und die Integration verschiedener optionaler Funktionen.
Referenzen:
[1]Liu P, Huang S, Ling S, et al. Foxp1 controls brown/beige adipocyte differentiation and thermogenesis through regulating β3-AR desensitization[J]. Nature Communications, 2019, 10(1): 5070.[2] Zeng B, Shen Q, Wang B, et al. Spexin ameliorated obesity-related metabolic disorders through promoting white adipose browning mediated by JAK2-STAT3 pathway[J]. Nutrition & Metabolism, 2024, 21(1): 22.
[3] Gehrke N, Biedenbach J, Huber Y, et al. Voluntary exercise in mice fed an obesogenic diet alterts the hepatic immune phenotype and improves metabolic parameters-an animal model of life style intervention in NAFLD[J]. Scientific Reports, 2019, 9(1): 4007.
[4] Marvyn P M, Bradley R M, Mardian E B, et al. Daten zur Sauerstoffverbrauchsrate, zum Atmungsaustauschverhältnis und zur Bewegung bei weiblichen C57BL/6J-Mäusen am dritten Tag des Verzehrs einer fettreichen Diät[J]. Data in brief, 2016, 7: 472-475.
[5]John L M, Petersen N, Gerstenberg M K, et al. Housing-temperature reveals energy intake counter-balances energy expenditure in normal-weight, but not diet-induced obese, male mice[J]. Mitteilungen Biologie, 2022, 5(1): 946.
[6]Wu Y, Yang M, Wu S, et al. Zinc finger BED-type containing 3 promotes hepatic steatosis by interacting with polypyrimidine tract-binding protein 1[J]. Diabetologia, 2024, 67(10): 2346-2366.





