Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Neues aus der Industrie
{{{sourceTextContent.title}}}
Das Tow-Int Tech-System zur Überwachung des Tierstoffwechsels
{{{sourceTextContent.subTitle}}}
Unterstützt die Forschung über Anorexie und Adipositas
{{{sourceTextContent.description}}}
Einführung
Kürzlich untersuchten einheimische Forscher, darunter Zijun Chen, Yixiao Luo, Yingjie Zhu und andere, den Wirkmechanismus von Liraglutid bei Mäusen. Sie entdeckten, dass GLP-1-Rezeptor (GLP-1R)-positive Neuronen im lateralen Septum (LS) eine entscheidende Rolle bei der magersüchtigen und gewichtsreduzierenden Wirkung von Liraglutid spielen. Ihre Ergebnisse wurden in der Fachzeitschrift The Journal of Clinical Investigation veröffentlicht, die im Jahr 2023 einen Impact Factor von 15,9 und in den letzten fünf Jahren einen Impact Factor von 14,6 aufwies.
1. Forschungshintergrund
Fettleibigkeit ist eine globale Gesundheitsbedrohung, und Liraglutid, ein Analogon des Glucagon-like Peptide-1 (GLP-1), wird zur Behandlung von Fettleibigkeit eingesetzt. Die spezifischen neuronalen Wirkorte sind jedoch nach wie vor unklar. GLP-1R-exprimierende Zellen im zentralen Nervensystem sind für die magersüchtigen und gewichtsreduzierenden Wirkungen von Liraglutid entscheidend. Der Hypothalamus war ein wichtiger Forschungsschwerpunkt, aber die genetische Deletion von GLP-1R in dieser Region hat keinen Einfluss auf die Wirkung von Liraglutid. Die Regionen des Hinterhirns, wie z. B. der kaudale Bereich, sind ebenfalls von Interesse, obwohl es widersprüchliche Ergebnisse gibt. Das laterale Septum (LS) exprimiert ebenfalls GLP-1R und ist an der Energieregulierung beteiligt, aber die physiologische Funktion seiner Neuronen und ihre Rolle bei der Wirkung von Liraglutid sind noch unklar.
2. Ziel der Forschung
Ziel der Studie ist es, die Rolle der GLP-1Rs im Septum lateralis bei den physiologischen und pharmakologischen Wirkungen von Liraglutid aufzudecken, einschließlich der Regulierung der Energiehomöostase und ihrer Beteiligung an den durch Liraglutid ausgelösten anorektischen und gewichtsreduzierenden Wirkungen.
3. Experimentelle Methoden
Tiermodelle: Es wurden verschiedene transgene Mäuse verwendet, darunter GLP-1R-ires-Cre-Mäuse, Ai14-Reportermäuse, Rosa26-LSL-Cas9-Mäuse und Wildtyp-C57BL/6J-Mäuse.
Techniken:
Immunhistochemie: Zur Bestimmung der Verteilung von GLP-1Rs im Mäusegehirn.
Injektion von viralen Vektoren: Einschließlich des Einsatzes der CRISPR/Cas9-Technologie zum selektiven Ausschalten der GLP-1R-Expression in bestimmten Neuronen oder zur Überexpression von GLP-1R.
Chemogenetik und Optogenetik: Zur Aktivierung oder Hemmung GLP-1R-positiver Neuronen im Septum lateralis.
Faser-Photometrie: Zur Aufzeichnung der neuronalen Aktivität.
Elektrophysiologie: Zur Untersuchung der synaptischen Übertragung in Neuronen.
Behaviorale Experimente: Einschließlich Messungen der Nahrungsaufnahme, des Körpergewichts, oraler Glukosetoleranztests und konditionierter Geschmacksaversionstests.
4. Experimentelle Ergebnisse
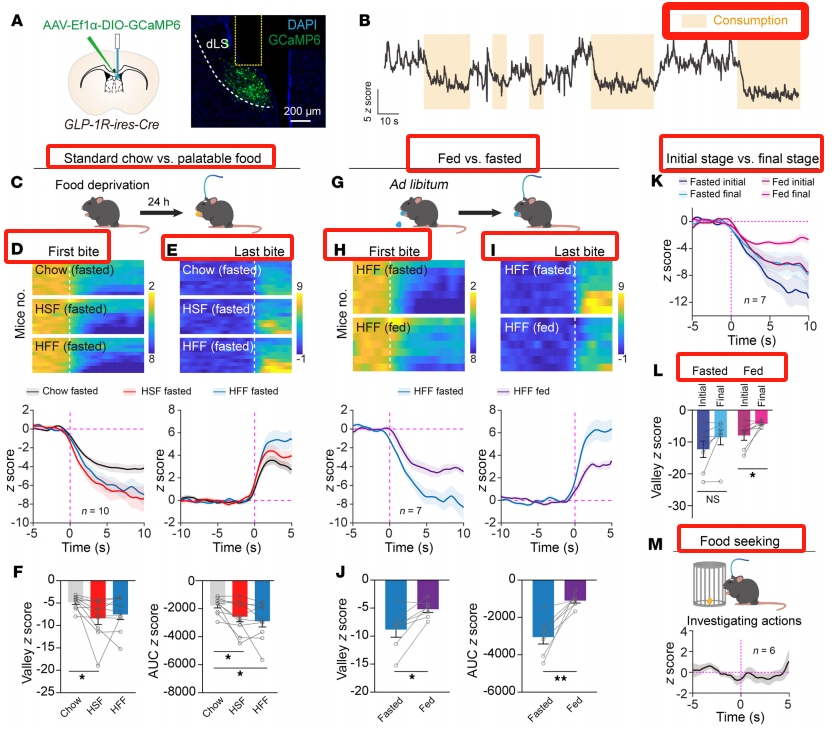
Liraglutid aktiviert GLP-1R-Neuronen in der Seitenscheidewand. Die Immunhistochemie zeigte, dass GLP-1R-positive Neuronen dicht im dorsalen Teil des lateralen Septums (dLS) verteilt sind. Nach intraperitonealer Injektion von Liraglutid war die c-Fos-Expression im LS, im paraventrikulären Nukleus (PVN) und im kaudalen Bereich (AP) erhöht. Durch Kreuzung von GLP-1R-ires-Cre-Mäusen mit Ai14-Reportermäusen wurden GLP-1R-positive Neuronen im LS markiert, und es wurde festgestellt, dass die intraperitoneale Injektion von Liraglutid die c-Fos-Expression in diesen Neuronen signifikant erhöhte. Eine lokale Infusion von Liraglutid in den LS hatte die gleiche Wirkung und erhöhte die Amplitude der exzitatorischen postsynaptischen Ströme.
GLP-1R-Knockout im LS schwächt die Wirkung von Liraglutid ab
Mithilfe der CRISPR/Cas9-Technologie wurde die GLP-1R-Expression in GLP-1R-positiven Neuronen im dorsalen lateralen Septum (dLS) gezielt ausgeschaltet. Der Knockout wirkte sich nicht auf die Ausgangsnahrungsaufnahme oder das Körpergewicht der Mäuse aus, schwächte aber die Wirkung von Liraglutid auf die Nahrungsaufnahme und den Gewichtsverlust ab. Das Ausschalten von GLP-1R im paraventrikulären Nukleus (PVN) und im Arcuate Nucleus (Arc) veränderte die magersüchtigen Wirkungen von Liraglutid nicht.
Überexpression von GLP-1R in der dLS reduziert die Nahrungsaufnahme bei satten Mäusen
Die Überexpression von GLP-1R im dorsalen lateralen Septum (dLS) verringerte die Nahrungsaufnahme von Mäusen mit Sättigungsgefühl signifikant, hatte aber keinen Einfluss auf die Nahrungsaufnahme von nüchternen Mäusen. Darüber hinaus wurden weder das chronische Körpergewicht noch Stoffwechselparameter verändert.
Das Ausschalten von LS-GLP-1R-Neuronen erhöht die Nahrungsaufnahme und fördert die Fettleibigkeit
Das Ausschalten von LS-GLP-1R-Neuronen (durch Injektion von AAV, das Tetanustoxin exprimiert) erhöht die Aufnahme von fettreicher Nahrung und das Körpergewicht sowie den Verzehr von schmackhaften Nahrungsmitteln. Die Glukosetoleranz und der Wasserverbrauch werden jedoch nicht beeinträchtigt, dafür steigen der Energieverbrauch und das Verhältnis der Atemwege. Das Ausschalten dieser Neuronen schwächt die Wirkung von Liraglutid auf die Nahrungsaufnahme und den Gewichtsverlust ab, hat aber keinen Einfluss auf die durch Liraglutid ausgelöste Übelkeit.
Die Aktivität der LS-GLP-1R-Neuronen nimmt während der Nahrungsaufnahme rasch ab
Faserphotometrische Aufzeichnungen zeigten, dass das Ca²⁺-Signal der LS-GLP-1R-Neuronen signifikant abnahm, wenn Mäuse mit Nahrungsentzug zu fressen begannen, und nach Beendigung der Nahrungsaufnahme auf das Ausgangsniveau zurückkehrte. Der Rückgang war stärker ausgeprägt, wenn das Futter schmackhafter war. Wenn Mäusen mit Sättigungsgefühl fettreiche Nahrung angeboten wurde, war die hemmende Reaktion geringer, und die Hemmung während der Nahrungsaufnahme nahm allmählich ab. Das Verhalten bei der Nahrungssuche hatte keinen Einfluss auf die neuronale Aktivität.
Die Aktivierung von LS-GLP-1R-Neuronen reduziert den Nahrungskonsum
Die Aktivierung von LS-GLP-1R-Neuronen durch Chemogenetik oder Optogenetik kann die Nahrungsaufnahme reduzieren und den Appetit unterdrücken, ohne die Glukosehomöostase zu beeinträchtigen. LS-GLP-1R-Neuronen projizieren in mehrere Hirnregionen, die an der Essensregulierung beteiligt sind.
5. Schlussfolgerung der Forschung
Liraglutid aktiviert GLP-1R-positive Neuronen im lateralen Septum, und die GLP-1Rs in dieser Region spielen eine wichtige Rolle bei den magersüchtigen und gewichtsreduzierenden Wirkungen von Liraglutid. Die GLP-1R-Neuronen in den LS sind sowohl für das physiologische Sättigungsgefühl als auch für die durch Liraglutid ausgelösten Wirkungen von zentraler Bedeutung und bieten neue Einblicke in die Wirkungsmechanismen von Liraglutid sowie potenzielle Angriffspunkte für die Behandlung von Fettleibigkeit.
Ergebnisse der Forschung:
Vertiefung des Verständnisses der Mechanismen der Fettleibigkeit: Diese Studie klärt die Bedeutung von GLP-1R-positiven Neuronen im lateralen Septum bei der Regulierung der Energiehomöostase und trägt damit zum Verständnis der neurobiologischen Mechanismen der menschlichen Fettleibigkeit bei. Adipositas steht in engem Zusammenhang mit einem Ungleichgewicht von Energieaufnahme und -verbrauch, und die in dieser Studie aufgedeckten neuronalen Bahnen spielen eine entscheidende Rolle und bieten eine neue Perspektive auf die Pathophysiologie der Adipositas.
Erklärung der Mechanismen von Arzneimittelnebenwirkungen: Die Studie ergab, dass LS GLP-1R-Neuronen nicht an der Liraglutid-induzierten Übelkeit beteiligt sind, was darauf hindeutet, dass andere Hirnregionen an der Übelkeitsreaktion beteiligt sind. Dies hilft zu erklären, warum bei einigen Patienten Nebenwirkungen wie Übelkeit auftreten, wenn sie GLP-1R-Agonisten (z. B. Liraglutid) zur Behandlung von Fettleibigkeit oder Diabetes einsetzen, und bietet eine theoretische Grundlage für weitere Forschungsarbeiten zur Behandlung dieser Nebenwirkungen.
Identifizierung potenzieller Angriffspunkte für Medikamente: Die Forschung unterstreicht die kritische Rolle der GLP-1Rs im lateralen Septum bei der Wirkung von Liraglutid, was darauf hindeutet, dass diese Region oder die mit ihr verbundenen Neuronen potenzielle Ziele für die Behandlung von Fettleibigkeit und damit verbundenen Stoffwechselkrankheiten sein könnten. Die Entwicklung von Medikamenten, die auf diesen Signalweg abzielen, könnte die Wirksamkeit und Sicherheit von Behandlungen verbessern und gleichzeitig die Nebenwirkungen verringern.
Optimierung der medikamentösen Behandlungsstrategien: Die Ergebnisse könnten dazu beitragen, präzisere medikamentöse Behandlungsmethoden zu entwickeln, wie z. B. die Modulation der Aktivität von GLP-1R-positiven Neuronen in der Seitenscheidewand, um die magersüchtige und gewichtsreduzierende Wirkung von Liraglutid zu verstärken und gleichzeitig unerwünschte Wirkungen wie Übelkeit zu vermeiden oder zu verringern. Dies eröffnet Möglichkeiten für eine personalisierte Medizin.
Förderung kombinierter Behandlungsansätze: In Anbetracht der Tatsache, dass GLP-1Rs in verschiedenen Hirnregionen zusammenarbeiten können, um die Wirkungen von Liraglutid zu vermitteln, könnte die künftige Arzneimittelentwicklung die Entwicklung kombinierter Behandlungsstrategien in Betracht ziehen, die auf mehrere relevante Signalwege oder Hirnregionen abzielen, um die Wirksamkeit von Behandlungen gegen Fettleibigkeit und verwandte Krankheiten zu verbessern.
In dieser Studie wurde das Animal Metabolism Monitoring System von Tow-Int Tech verwendet, das Parameter wie Energieverbrauch, Sauerstoffaufnahme (VO₂), Kohlendioxidausstoß (VCO₂), Atemaustauschverhältnis, Nahrungs- und Wasseraufnahme und andere Stoffwechselparameter misst. Dieses System ermöglicht die Langzeitüberwachung von Mäusen unter natürlichen Aktivitätsbedingungen und liefert Daten für die Untersuchung der Auswirkungen von Medikamenten oder neuronaler Modulation auf den Energiestoffwechsel.
Messung des Energieverbrauchs (EE):
Der Energieverbrauch wird gemessen, indem der Sauerstoffverbrauch (VO₂) und der Kohlendioxidausstoß (VCO₂) von Mäusen über einen bestimmten Zeitraum im Energiestoffwechselsystem überwacht und dann der Energieverbrauch anhand bestimmter Formeln berechnet wird. Dies hilft, die Veränderungen des Energieverbrauchs von Mäusen unter verschiedenen experimentellen Bedingungen (z. B. Aktivierung oder Hemmung von LS GLP-1R-Neuronen) zu verstehen und die Auswirkungen dieser Manipulationen auf das Gesamtenergiestoffwechselniveau der Mäuse zu bewerten.
Überwachung des Sauerstoffverbrauchs (VO₂) und des Kohlendioxidausstoßes (VCO₂):
Echtzeit- und kontinuierliche Messungen von VO₂ und VCO₂ bei Mäusen im Rahmen des Energiestoffwechselsystems liefern Daten zum Gasaustausch in verschiedenen Aktivitätszuständen (z. B. in aktiven und ruhenden Phasen). Die Studie ergab, dass unter bestimmten experimentellen Bedingungen (z. B. nach dem Ausschalten von LS GLP-1R-Neuronen) die VO₂- und VCO₂-Werte verändert waren. Dies liefert wichtige Daten für die Analyse der Beziehung zwischen neuronaler Aktivität und Energiestoffwechsel.
Berechnung des Atmungsaustauschverhältnisses (RER):
Das RER ist das Verhältnis von VCO₂-Produktion zu VO₂-Verbrauch und spiegelt die metabolische Nutzung von Kohlenhydraten und Fetten in der Maus wider. Die Studie berechnet den RER anhand von Daten aus dem Energiestoffwechselsystem und stellte fest, dass sich VO₂ und VCO₂ zwar unter bestimmten Bedingungen (z. B. nach dem Silencing von LS GLP-1R-Neuronen) veränderten, der RER sich jedoch nicht veränderte. Dies deutet darauf hin, dass die metabolische Substratnutzung der Mäuse unter diesen Bedingungen keine wesentlichen Veränderungen erfuhr, was unser Verständnis der neuronalen Regulierung des Energiestoffwechsels weiter vertieft.
Gleichzeitige Messung von Nahrungs- und Wasseraufnahme:
Das Energiestoffwechselsystem kann Energiestoffwechselparameter messen und gleichzeitig die Nahrungs- und Wasseraufnahme der Mäuse aufzeichnen. Dies ermöglicht eine umfassende Analyse des Gleichgewichts zwischen Energieaufnahme und -verbrauch sowie der Auswirkungen verschiedener experimenteller Behandlungen auf dieses Gleichgewicht. Bei der Untersuchung der Beziehung zwischen Manipulationen an LS GLP-1R-Neuronen und Veränderungen der Nahrungsaufnahme ermöglicht die Kombination von Daten über den Energieverbrauch, die mit dem metabolischen Käfig gemessen wurden, ein umfassenderes Verständnis der Rolle dieser Neuronen bei der Regulierung der Energiehomöostase.
Das Tow-Int Tech Animal Metabolism Monitoring System hat umfassende und kontinuierliche Daten zum Energiestoffwechsel von Mäusen geliefert, die für die Aufdeckung der Mechanismen, durch die LS GLP-1R-Neuronen den Energiehaushalt regulieren, von entscheidender Bedeutung sind. Sie bieten eine solide Grundlage für nachfolgende Analysen und Schlussfolgerungen.
Kontaktieren Sie uns jetzt!
Wir setzen uns dafür ein, Ihre Forschung einfacher, genauer und effizienter zu machen und Ihnen zu helfen, Vertrauen in Ihre Daten aufzubauen! Wir haben für eine Vielzahl von Kunden Dienstleistungen erbracht und verfügen daher über reiche Erfahrungen im Angebot von maßgeschneiderten, professionellen Lösungen für Ihre Bedürfnisse.





