#Produkttrends
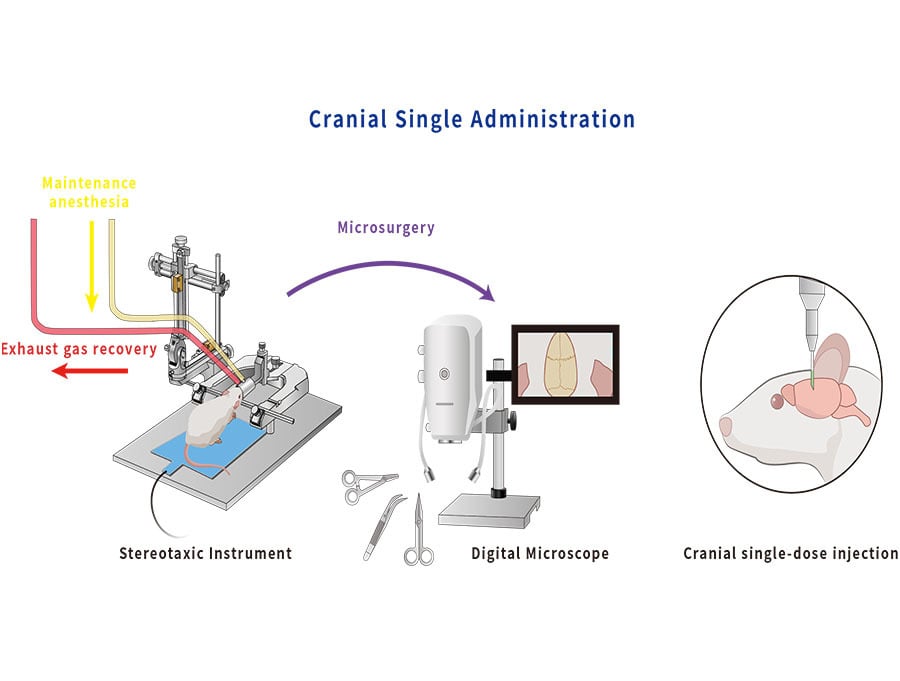
Protokoll verschiedener Methoden zur intrakraniellen Injektion
Auf dem Gebiet der hirnwissenschaftlichen Grundlagenforschung ist die intrakranielle stereotaktische Injektion der direkteste Weg, um eine präzise Injektion in Zielregionen des Gehirns zu erreichen, und ist zu einem wichtigen Bestandteil der meisten
Kombiniert mit dem passenden Lichtleiter ermöglicht es zudem eine optische Stimulation oder neuronale Signalerfassung der Zielregion des Gehirns während oder nach der Injektion. Diese Methode ist weit verbreitet in Tiermodellen von menschlichen neurologischen Erkrankungen, fortgeschrittenen Gehirnfunktionen, Emotionen, Kognition und anderen verwandten Studien.
Die intrakranielle stereotaktische Injektion wird üblicherweise in Einzelverabreichung und Mehrfachverabreichung angewendet. Im Versuch kann je nach Injektionshäufigkeit, Eintrittszeitpunkt und Wirkungsdauer die geeignete Methode ausgewählt werden. In diesem Dokument werden wir diese beiden Methoden im Detail erläutern, einschließlich der SOP und Tipps.
SOP der Cranial Single Administration
1 Instrumente
Stereotaktischer Apparat
Anästhesiegerät für Labortiere
Mikrospritzenpumpe
Mikropipettenzieher
2 Prozess und Verfahren
2.1 Tieranästhesie vor der Operation
Schalten Sie das Tier Anästhesiegerät ein. Legen Sie die Ratte in die Induktionsbox, um eine induzierte Anästhesie durchzuführen. Sobald die Ratte unter Anästhesie steht, nehmen Sie sie aus der Induktionsbox und übertragen Sie sie mit einem Heizkissen auf die Anästhesiemaske am stereotaktischen Instrument. Tragen Sie [XY1] Augensalbe auf ihre Augen auf und bereiten Sie die Haut vor.
2.2 Repariere den Schädel
2.2.1 Setzen Sie den Schneidezahn der Ratte in das Loch der Maske und schrauben Sie den Nasenclip vorsichtig fest.
2.2.2 Verschieben Sie die Ohrbügel auf einer Seite in die entsprechende Position und schrauben Sie sie fest. Halten Sie den Kopf der Ratte sanft und richten Sie die Position des großen Hinterhauptslochs auf derselben Seite des Kopfes mit der Spitze der Ohrstange aus und schieben Sie die andere Seite der Ohrstange langsam auf das große Hinterhauptsloch.
2.2.3 Passen Sie die Position der Ohrbügel auf zwei Seiten an, bis die Messwerte auf der linken und rechten Seite gleich sind.
2.3 Bohre ein Loch in den Schädel
(2.3.1) Befestigen Sie den Mikrobohrer mit dem Mikrobohrerhalter am stereotaktischen Gehirninstrument und bewegen Sie den Mikrobohrer langsam, um das Bregma zu berühren, und stellen Sie auf der Digitalanzeige Null ein. Bewegen Sie den Mikrobohrer langsam, um das Lambda zu berühren, um den Wert von DV aufzuzeichnen. Wenn der Absolutwert kleiner als 0,03 mm ist, kann der Schädel in horizontaler Position betrachtet werden; wenn er größer als 0,03 mm ist, muss die Höhe des Adapters angepasst werden, und die Positionen von Bregma und Lambda müssen neu kalibriert werden, bis der absolute Wert von Lambda DV kleiner als 0,03 mm ist.
2.3.2 Bewegen Sie den Schädelbohrer zum Mittelpunkt der Bregma- und Lambda-Linie und erweitern Sie die linke und rechte Seite um 0,3 mm. Berühren Sie die kraniale Oberfläche sanft und zeichnen Sie die kraniofazialen DV-Werte am linken bzw. rechten Punkt auf. Wenn die absolute Differenz weniger als 0,03 mm beträgt, kann der Schädel in horizontaler Position betrachtet werden; Wenn sie größer als 0,03 mm ist, sollte die Höhe der beiden Ohrbügel angepasst werden, bis die absolute Differenz weniger als 0,03 mm beträgt.
2.3.3 Bewegen Sie den Schädelbohrer langsam über die Zielstelle. Schalten Sie den Schädelbohrer ein und senken Sie ihn dann langsam ab, während Sie den Bohrer unter dem Mikroskop beobachten, bis er die Dura erreicht.
2.4 Intrakranielle Injektion
2.4.1 Verwenden Sie die Glaskapillare, um die Glaskapillare zu ziehen, indem Sie sich auf die Parameter des Injektionsprogramms beziehen.
2.4.2 Verwenden Sie eine Füllnadel, um die Glaskapillare mit Mineralöl zu füllen, und schnippen Sie die Glaskapillare, bis die Blasen an der Spitze austreten.
2.4.3 Lösen Sie das Spannfutter der Mikropipetten-Injektionspumpe, um die Glaskapillare vorsichtig nach oben zu drücken, und ziehen Sie dann das Spannfutter fest.
2.4.4 Parameter für Entleerungsgeschwindigkeit und Entleerungsvolumen in der Steuereinheit einstellen und klicken, um die Entleerung auszuführen.
2.4.5 Tauchen Sie die Kapillarspitze in die zu injizierende Lösung. Parameter für Füllgeschwindigkeit und Füllvolumen in der Steuereinheit einstellen und zum Befüllen klicken.
2.4.6 Befestigen Sie die Mikropipetten-Injektionspumpe am Betätigungsarm. Bewegen Sie nach dem Zurücksetzen der Kapillarspitze auf Null den Operationsarm über die Zielstelle und senken Sie sich langsam in die Zielregion des Gehirns ab.
2.4.7 Stellen Sie die Parameter für Injektionsgeschwindigkeit und -volumen in der Steuereinheit ein und klicken Sie, um die Injektion auszuführen.
2.4.8 Bewegen Sie nach der Injektion die Mikropipetten-Injektionspumpe langsam nach oben, bis die Spitze der Glaskapillare aus dem Hirngewebe entfernt ist.
2.5 Naht
2.5.1 Vernähen Sie die Kopfhaut mit sterilem Nahtmaterial und tragen Sie dann die Erythromycin-Augensalbe auf, um Wundentzündungen vorzubeugen.
2.6 Postoperative Versorgung
2.6.1 Halten Sie die Ratte 24 h nach der Operation warm. Injizieren Sie Penicillin oder andere Antibiotika, um eine Infektion zu verhindern, und versorgen Sie die Ratte mit ausreichend Futter und Trinkwasser.
3 Tipps
3.1 Nachdem die Spitze der Glaskapillare die Zielstelle erreicht hat, lassen Sie die Kapillare 1 Minute lang an der Injektionsstelle, um den Luftdruck vor der Injektion auszugleichen.
3.2 Damit das Injektionsreagenz vollständig vom Gehirngewebe absorbiert wird, stoppen Sie die Injektion für 15-20 Minuten nach der Injektion und ziehen Sie dann die Glaskapillare heraus.
3.3 Um das Austreten von Reagenzien auf der Bewegungsbahn der Glaskapillare zu reduzieren, wird empfohlen, die Nadeleinlass- und -auslassgeschwindigkeit auf 0,01 mm/s zu steuern.
SOP der Cranial Multiple Administration
1 Instrumente
Stereotaktischer Apparat
Kanüle zur Medikamentenverabreichung
Mikrospritzenpumpe
2 Prozess und Verfahren
2.1 Tieranästhesie vor der Operation
2.1.1 Schalten Sie das Tiernarkosegerät ein. Legen Sie die Ratte in die Induktionsbox, um eine induzierte Anästhesie durchzuführen. Sobald die Ratte unter Anästhesie steht, nehmen Sie sie aus der Induktionsbox und übertragen Sie sie mit einem Heizkissen auf die Anästhesiemaske am stereotaktischen Instrument. Tragen Sie zur Vorbereitung Augensalbe auf die Augen auf und rasieren Sie die Kopfhaut.
2.2 Repariere den Schädel
2.2.1 Setzen Sie den Schneidezahn der Ratte in das Loch der Maske und schrauben Sie den Nasenclip vorsichtig fest.
2.2.2 Verschieben Sie die Ohrbügel auf einer Seite in die entsprechende Position und schrauben Sie sie fest. Halten Sie den Kopf der Ratte sanft und richten Sie die Position des großen Hinterhauptslochs auf derselben Seite des Kopfes mit der Spitze der Ohrstange aus und schieben Sie die andere Seite der Ohrstange langsam auf das große Hinterhauptsloch.
2.2.3 Passen Sie die Position der Ohrbügel auf zwei Seiten an, bis die Messwerte auf der linken und rechten Seite gleich sind.
2.3 Schädelnivellierung
2.3.1 Befestigen Sie den Mikrobohrer mit dem Mikrobohrerhalter am stereotaktischen Gehirninstrument und bewegen Sie den Mikrobohrer langsam, um das Bregma zu berühren, und stellen Sie auf der Digitalanzeige Null ein. Bewegen Sie den Mikrobohrer langsam, um das Lambda zu berühren, um den Wert von DV aufzuzeichnen. Wenn der Absolutwert kleiner als 0,03 mm ist, kann der Schädel in horizontaler Position betrachtet werden; wenn er größer als 0,03 mm ist, muss die Höhe des Adapters angepasst werden, und die Positionen von Bregma und Lambda müssen neu kalibriert werden, bis der absolute Wert von Lambda DV kleiner als 0,03 mm ist.
2.3.2 Bewegen Sie den Schädelbohrer zum Mittelpunkt der Bregma- und Lambda-Linie und erweitern Sie die linke und rechte Seite um 0,3 mm. Berühren Sie die kraniale Oberfläche sanft und zeichnen Sie die kraniofazialen DV-Werte am linken bzw. rechten Punkt auf. Wenn die absolute Differenz weniger als 0,03 mm beträgt, kann der Schädel in horizontaler Position betrachtet werden; Wenn sie größer als 0,03 mm ist, sollte die Höhe der beiden Ohrbügel angepasst werden, bis die absolute Differenz weniger als 0,03 mm beträgt.
2.4 Bohre ein Loch in den Schädel
2.4.1 Bewegen Sie den Schädelbohrer langsam über die Zielstelle. Schalten Sie den Schädelbohrer ein und senken Sie ihn dann langsam ab, während Sie den Bohrer unter dem Mikroskop beobachten, bis er die Dura mater cerebralis erreicht.
2.4.2 Bewegen Sie den Mikrobohrer langsam und bohren Sie zwei kleine Löcher in die Vorder- und Rückseite der Zielregion des Gehirns. Führen Sie die sterilen Schrauben vorsichtig mit einem Schraubendreher in den Schädel ein.
2.5 Kanülenimplantation zur Arzneimittelabgabe
2.5.1 Klemmen Sie die Führungskanüle fest und bewegen Sie sie langsam zu Bregma und setzen Sie den Nullpunkt zurück. Bewegen Sie dann die Führungskanüle über die Zielstelle und senken Sie sie langsam zum Zielbereich ab.
2.5.2 Tragen Sie eine angemessene Menge biologischen Klebers auf die Schädelöffnung auf.
2.5.3 Bereiten Sie halbviskosen Zahnzement vor, der Schicht für Schicht, Zone für Zone zwischen Schraube und Führungskanüle gefüllt wird.
2.5.4 Schrauben Sie die Führungskanülenkappe fest, nachdem der Zahnzement vollständig ausgehärtet ist.
2.6 Arzneimittelabgabe mit Kanüle
2.6.1 Verwenden Sie den PE-Schlauch über der Befestigungsschraube und füllen Sie den PE-Schlauch und die Injektionsnadel mit Mineralöl. Nachdem die Spritze mit Mineralöl gefüllt ist, verwenden Sie eine Klebepistole, um die Verbindung zwischen dem PE-Rohr und der Spritze abzudichten, und entleeren Sie das Mineralöl in der Spritze.
2.6.2 Befestigen Sie die Spritze im Antriebstank der Spritzenpumpe. Die Spritzenpumpe führt den Saugvorgang durch und inhaliert das Medikament aus der Spitze der Injektionskanüle.
2.6.3 Entfernen Sie die Blindkanüle. Führen Sie die Injektionskanüle in die Führungskanüle ein
langsam und ziehen Sie die Befestigungsschraube fest.
2.6.4 1 Minute ruhen lassen und den Tieren mit dem Injektionsschlauch ermöglichen, sich an die Umgebung anzupassen.
2.6.5 Injektionsparameter der Injektionspumpe einstellen und Injektionsvorgang durchführen.
2.6.6 Unterbrechen Sie die Injektion nach der Injektion für 1-5 Minuten. Entfernen Sie dann den inneren Injektionsschlauch und ziehen Sie die Katheterkappe wieder fest. Die Injektion ist abgeschlossen.
2.7 Postoperative Versorgung
Halten Sie die Ratte nach der Operation 24 h warm. Injizieren Sie Penicillin oder andere Antibiotika, um eine Infektion zu verhindern, und versorgen Sie die Ratte mit ausreichend Futter und Trinkwasser.
3 Tipps
3.1 Beim Bohren von Löchern an der Stelle, an der Schädelschrauben eingebettet sind, muss besonders darauf geachtet werden, dass der Schädel nicht durchbohrt und Hirngewebe nicht beschädigt wird. Außerdem sollte die Bohrstelle so weit wie möglich vom Implantationsbereich der Kanüle entfernt gehalten werden, um eine Blockierung der kranialen Schraube zu vermeiden.
3.2 Bei bilateraler Implantation implantieren Sie zuerst die rechte Einzelkanüle, um die räumliche Obstruktion zu vermeiden.
3.3 Tragen Sie den Zahnzement Schicht für Schicht auf, um die Implantation zu festigen.