Automatische Übersetzung anzeigen
Dies ist eine automatisch generierte Übersetzung. Wenn Sie auf den englischen Originaltext zugreifen möchten, klicken Sie hier
#Neues aus der Industrie
{{{sourceTextContent.title}}}
Leitfaden zur Faserphotometrie für Einsteiger
{{{sourceTextContent.subTitle}}}
die Technologie der Faserphotometrie erlernen
{{{sourceTextContent.description}}}
Wenn Sie gerade erst anfangen, sich mit der Technologie der Faserphotometrie vertraut zu machen, dürfte dieser Artikel sehr hilfreich für Sie sein.
Die Faserphotometrie ist eine optische Methode, die auf dem Prinzip der Messung des von fluoreszierenden Molekülen emittierten Lichts mittels zeitkorrelierter Einzelphotonenzählung (TCSPC) auf der Grundlage von Glasfasern beruht. Aus diesem Prinzip ergibt sich, dass für die Durchführung dieses Experiments Sonden erforderlich sind, die Fluoreszenz im Gewebe ausdrücken können, sowie eine Reihe von Geräten, die Fluoreszenz übertragen und nachweisen können.
Betrachten wir also zunächst die Fluoreszenzgeräte. Die derzeit am häufigsten verwendeten Fluoreszenzinstrumente werden in Kalziumindikatoren, Neurotransmitterindikatoren, Spannungsindikatoren usw. unterteilt. Da es viele Arten von Tiermodellen für experimentelle Anwendungen gibt und wir außerdem bestimmte Hirnregionen oder sogar bestimmte Arten von Zellen untersuchen müssen, wurden Gen-Editing-Techniken in großem Umfang für die Entwicklung von Sonden verwendet.
Gängige genetisch kodierte Kalziumindikatoren (GECIs) sind fluoreszierende Proteine, die vom grün fluoreszierenden Protein (GFP usw.) und seinen Varianten (z. B. zirkulär angeordnetes GFP, YFP, CFP, RFP usw.) abgeleitet und mit Calmodulin (CaM) und der M13-Domäne der Myosin-Leichtketten-Kinase fusioniert sind. Wenn Ca2+ vorhanden ist, bindet es an CaM, was zu einer Interaktion zwischen der M13- und der CaM-Strukturdomäne führt und eine strukturelle Umstrukturierung von cpEGFP auslöst, wodurch das grün/rote Fluoreszenzsignal verstärkt wird.
Die am häufigsten verwendeten GECIs sind: GCaMP, Pericams, Cameleons, TN-XXL und Twitch, von denen GCaMP6 und GCaMP7 aufgrund ihrer höheren Empfindlichkeit inzwischen häufig in In-vivo-Studien zur Kalzium-Bildgebung eingesetzt werden. Im Folgenden finden Sie eine Zusammenfassung der gängigen GECI-Typen.
Abbildung 1
GCaMP6 GCaMP6s Hohe Empfindlichkeit, geeignet für niederfrequente Signale
GCaMP6m Mäßige Aktivität, breiter Anwendungsbereich
GCaMP6f Schnelle Dissoziation, geeignet für Hochfrequenzsignale
jGCaMP7 jGCaMP7s Hohe Empfindlichkeit und schneller als GCaMP6s
jGCaMP7f Verbesserte Df/F-Reaktion, geeignet für Experimente mit einzelnen Aktionspotenzialen oder Gruppenaktivität
jGCaMP7b Hohe Helligkeit des Ruhepotenzials, geeignet für Neuritis oder Nervenfasern
jGCaMP7c Hoher Kontrast, geeignet für Weitbereichsaufnahmen
jRGECO1a jRGECO1a Die Anregungswellenlänge ist rotverschoben und kann mit GCaMP verwendet werden
jRCaMP1 jRCaMP1a
jRCaMP1b
Axon-GCaMP Axon-GCaMP Markierung des Axons
Das Prinzip der Neurotransmittersonden ist ähnlich wie oben beschrieben, wobei cpEGFP in spezifische Neurotransmitterrezeptoren eingebettet wird und die Bindung der Rezeptoren an Neurotransmitter eine Konformationsänderung der Rezeptoren in ein Fluoreszenzsignal auslöst, und die Echtzeitveränderungen der Neurotransmitterkonzentration mit Hilfe von Bildgebungsverfahren beobachtet werden können. Zu den entwickelten Neurotransmittersonden gehören DA (Dopamin), Ach (Acetylcholin), NE (Noradrenalin), 5HT (5-Hydroxytryptamin), Ado (Adenosin), ATP (Adenosintriphosphat), CCK (Cholecystokinin), VIP (vasoaktives intestinales Peptid) und eCB (Endocannabinoid), usw.
Wegen des relativ langsamen Signalwechselzyklus von Kalziumsignalen und Neurotransmittern müssen wir, wenn wir das schnelle Signal des Membranpotenzials aufzeichnen wollen, entsprechende Instrumente wie genetisch kodierte Spannungsindikatoren (GEVI) verwenden. Änderungen des Membranpotenzials sind ein direktes Zeichen sowohl für synaptische als auch für Aktionspotenziale. In einigen Fällen ist das GEVI-Signal schneller und aussagekräftiger als Messungen mit GECI.
Nachdem wir diese fluoreszierenden Indikatoren verstanden haben, müssen wir uns darüber im Klaren sein, wie wir die Indikatoren in das Tier übertragen können. Diese genetisch kodierte Sonde kann in Zellen oder im Gehirn von Mäusen durch Virusinjektion, Transfektion, Kreuzung von Tieren und andere technische Mittel exprimiert werden. Nehmen wir die stereotaktische Injektionsstudie des Gehirns als Beispiel: 1. Wählen Sie das geeignete Virus (das die vom Indikator kodierte Information enthält), um es an einer bestimmten Stelle zu injizieren; 2.
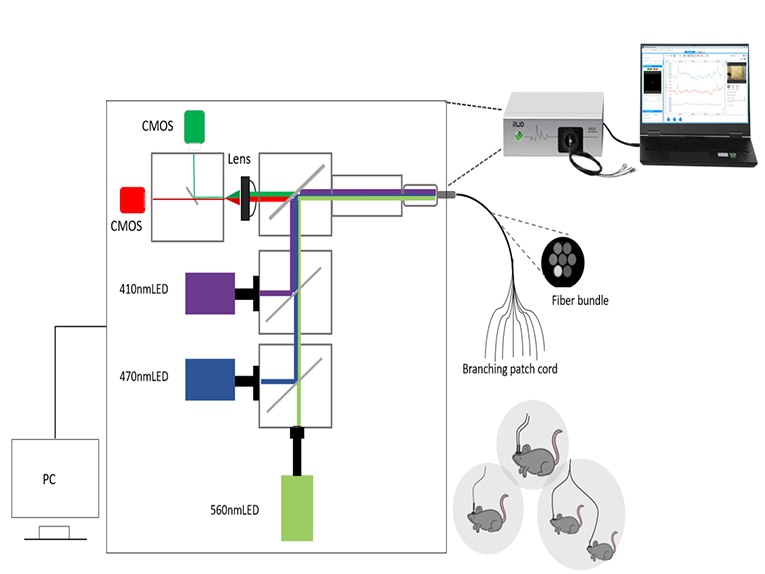
Sobald die Tiere vorbereitet sind, muss nun ein geeignetes System zur Erfassung und Analyse des Fluoreszenzsignals ausgewählt werden. Zu den grundlegenden Komponenten eines Faserphotometriesystems gehören Anregungslichtquellen, Filter, dichroitische Spiegel, Detektoren und faseroptisches Zubehör.
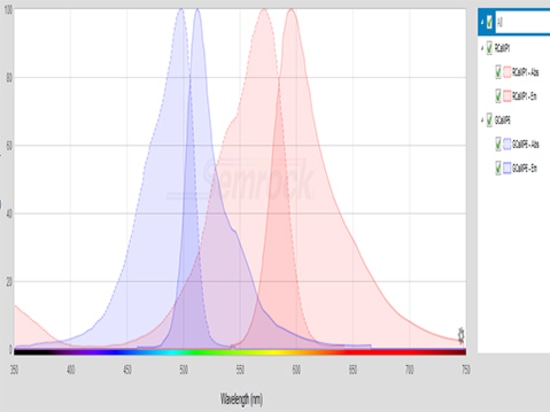
Die Anregungswellenlängen der GCaMP liegen zwischen 450nm und 500nm, die der RCaMP zwischen 530nm und 580nm. Die Anregungslichtquelle muss entsprechend dem Anregungswellenlängenbereich des Fluoreszenzindikators ausgewählt werden. Außerdem muss die geeignete Anregungsleistung gewählt werden, z.B. 20μW ~ 50μW ist besser geeignet für angeregte GCaMP, wenn die Leistung zu hoch ist, kann es leicht zu einer Signalausbleichung oder sogar -auslöschung führen.
Der Filter muss den Emissionswellenlängenbereich des fluoreszierenden Proteins berücksichtigen. Die Emissionswellenlänge von GCaMP liegt zwischen 500nm und 550nm, die von RCaMP zwischen 570nm und 630nm.
Es gibt viele Arten von Photodetektoren, wie z. B. PMT, CCD, CMOS, Photodioden, usw. Es wird allgemein angenommen, dass PMT (Photomultiplier Tube) hochempfindlich und für die Erkennung sehr schwacher Signale geeignet ist, aber nur für Einkanalexperimente; CCD kann für Mehrkanalaufnahmen verwendet werden, aber die Bildverarbeitungsgeschwindigkeit ist langsam; CMOS hat eine bessere Kostenleistung und kann für Mehrkanalaufnahmen verwendet werden, während die Bildverarbeitungsgeschwindigkeit schnell ist. Bei der experimentellen Mehrkanalaufzeichnung können mehrere verzweigte Glasfasern verwendet werden, wodurch ein System mehrere Gehirnbereiche oder Signaländerungen bei mehreren Tieren aufzeichnen kann.
Das faseroptische Zubehör muss mit einer schwarzen Schutzschicht und einem Material mit geringer Autofluoreszenz ausgewählt werden, um die Störung des Signals durch Umgebungslicht und Autofluoreszenz zu vermeiden. Die Auswahl des Zubehörs für faseroptische Experimente wird in folgendem Artikel erläutert: Wie wählt man faseroptisches Zubehör für eine möglichst effiziente Signalübertragung aus? - RWD Life Science (rwdstco.com)
Man könnte sich fragen, wie der Detektor zwischen den beiden unterschiedlichen Signalen unterscheiden kann, wenn ich zwei Farben eines fluoreszierenden Indikators in denselben Gehirnbereich injiziere? Keine Sorge, die beiden Signale können unabhängig voneinander erfasst werden, indem das Anregungslicht und die spezifische Öffnungszeit des Detektors über die Software gesteuert werden, oder indem zusätzliche Detektoren hinzugefügt werden.
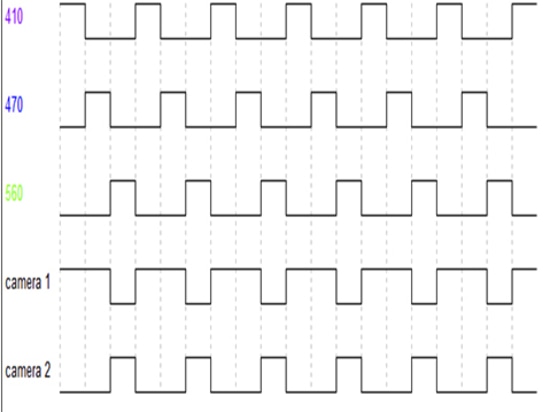
Wie in Abbildung 5 zu sehen ist, wechseln sich die Anregungsquellen 410nm LED, 470nm LED und 560nm LED bei der Ausgabe mit einer bestimmten Bildfrequenz (die über die Software eingestellt werden kann) ab. Die beiden Detektoren, Kamera1, synchronisieren die Signalerfassung nur am Ausgang der 410- und 470-nm-LEDs (entsprechend der Erfassung des GFP-Signals), und Kamera2 synchronisiert die Signalerfassung nur am Ausgang der 560-nm-LED (entsprechend der Erfassung des RFP-Signals).
Im RWD-Faserphotometriesystem haben wir einen Doppeldetektor plus TDM (Time-division multiplexing) zur Erfassung verwendet (RWD R820 Tricolor Multichannel Fiber Photometry System - YouTube). Obwohl in der Literatur bestätigt wurde, dass TDM in der Lage ist, die gegenseitige Interferenz von roter und grüner Fluoreszenz zu vermeiden. Allerdings verwendet der Einzeldetektor einen Zweibandfilter (der sowohl für Grün als auch für Rot durchgelassen werden kann), und es besteht die Möglichkeit, dass ein sehr geringes Übersprechen auftreten kann. Es besteht nämlich die Möglichkeit, dass die 470-nm-LED die rote Fluoreszenzsonde anregt, so dass die rote Fluoreszenz verstärkt wird und ein Übersprechen verursacht.
Welche Rolle spielt also die 410nm-LED? Warum brauche ich die 410-LED für die gleichzeitige Anregung bei der Aufnahme von GCaMP-Signalen? Die Fluoreszenzintensität von GCaMP bleibt konstant, wenn die intrazelluläre Ca2+-Konzentration bei einer Wellenlänge von 405 - 420 nm angeregt wird. Daher kann bis zu einem gewissen Grad davon ausgegangen werden, dass die Signaländerung bei 410 nm Anregung andere Rauschsignale als die Änderung der Ca2+-Konzentration widerspiegelt, wie z. B. Autofluoreszenz, bewegungsinduzierte Änderungen, Photobleiche usw. Bei der Datenverarbeitung kann das Hintergrundsignal gezielt entfernt werden, um das wahre Signal zu erhalten.
Die Wahl eines geeigneten Systems wird Ihr Experiment unterstützen. Wenn Sie mehr über das Faserphotometriesystem wissen möchten, kontaktieren Sie uns bitte!